রাদারফোর্ডের পরমাণুর ক্লাসিক্যাল মডেল। রাদারফোর্ডের পরীক্ষা
তারা পদার্থবিদ্যার উন্নয়নে একটি গুরুত্বপূর্ণ পদক্ষেপ হয়ে ওঠে। রাদারফোর্ডের মডেলটি অত্যন্ত গুরুত্বপূর্ণ ছিল। একটি সিস্টেম হিসাবে পরমাণু এবং এটি তৈরি করা কণাগুলি আরও সঠিকভাবে এবং বিশদভাবে অধ্যয়ন করা হয়েছিল। এটি পারমাণবিক পদার্থবিদ্যার মতো বিজ্ঞানের সফল বিকাশের দিকে পরিচালিত করেছিল।
পদার্থের গঠন সম্পর্কে প্রাচীন ধারণা
আশেপাশের দেহগুলি ক্ষুদ্র কণা দ্বারা গঠিত এই ধারণাটি প্রাচীনকালে তৈরি হয়েছিল। তৎকালীন চিন্তাবিদরা পরমাণুকে যে কোনো পদার্থের ক্ষুদ্রতম এবং অবিভাজ্য কণা হিসেবে কল্পনা করতেন। তারা যুক্তি দিয়েছিলেন যে মহাবিশ্বে একটি পরমাণুর চেয়ে আকারে ছোট কিছুই নেই। এই ধরনের মতামত মহান প্রাচীন গ্রীক বিজ্ঞানী এবং দার্শনিকদের দ্বারা অনুষ্ঠিত হয়েছিল - ডেমোক্রিটাস, লুক্রেটিয়াস, এপিকিউরাস। এই চিন্তাবিদদের অনুমান আজ "প্রাচীন পরমাণুবাদ" নামে একত্রিত হয়েছে।
মধ্যযুগীয় পারফরম্যান্স
প্রাচীনকালের সময় অতিবাহিত হয়েছে, এবং মধ্যযুগেও এমন বিজ্ঞানী ছিলেন যারা পদার্থের গঠন সম্পর্কে বিভিন্ন অনুমান করেছিলেন। যাইহোক, ইতিহাসের সেই সময়কালে ধর্মীয় দার্শনিক দৃষ্টিভঙ্গির প্রাধান্য এবং গির্জার শক্তি বস্তুবাদী বৈজ্ঞানিক সিদ্ধান্ত এবং আবিষ্কারের জন্য মানব মনের যেকোন প্রয়াস এবং আকাঙ্ক্ষাকে কুঁড়িতে ফেলে দেয়। আপনি জানেন যে, মধ্যযুগীয় ইনকুইজিশন সেই সময়ের বৈজ্ঞানিক বিশ্বের প্রতিনিধিদের সাথে খুব বন্ধুত্বপূর্ণ আচরণ করেছিল। এটা বলাই বাহুল্য যে সেই সময়ের উজ্জ্বল মনের ধারণা ছিল পরমাণুর অবিভাজ্যতার ধারণা, যা প্রাচীনকাল থেকে এসেছে।
18 এবং 19 শতকের গবেষণা
18 শতক পদার্থের প্রাথমিক কাঠামোর ক্ষেত্রে গুরুতর আবিষ্কার দ্বারা চিহ্নিত করা হয়েছিল। অ্যান্টোইন ল্যাভয়েসিয়ার, মিখাইল লোমোনোসভ এবং একে অপরের থেকে স্বাধীনভাবে বিজ্ঞানীদের প্রচেষ্টার জন্য অনেকাংশে ধন্যবাদ, তারা প্রমাণ করতে সক্ষম হয়েছিল যে পরমাণু সত্যিই বিদ্যমান। কিন্তু তাদের অভ্যন্তরীণ কাঠামোর প্রশ্ন উন্মুক্ত থেকে যায়। 18 শতকের শেষের দিকে রাসায়নিক উপাদানগুলির পর্যায়ক্রমিক পদ্ধতির ডি.আই. এটি সেই সময়ের একটি সত্যিকারের শক্তিশালী অগ্রগতি ছিল এবং সমস্ত পরমাণুর একটি একক প্রকৃতি রয়েছে এবং তারা একে অপরের সাথে সম্পর্কিত যে বোঝার উপর পর্দা তুলেছিল। পরবর্তীতে, 19 শতকে, পরমাণুর গঠন উন্মোচনের দিকে আরেকটি গুরুত্বপূর্ণ পদক্ষেপ ছিল প্রমাণ যে তাদের যে কোনোটিতে একটি ইলেকট্রন রয়েছে। এই সময়ের মধ্যে বিজ্ঞানীদের কাজ 20 শতকের আবিষ্কারের জন্য উর্বর ভূমি প্রস্তুত করেছিল।

থমসনের পরীক্ষা
ইংরেজ পদার্থবিদ জন থমসন 1897 সালে প্রমাণ করেন যে পরমাণুতে ঋণাত্মক চার্জ সহ ইলেকট্রন থাকে। এই পর্যায়ে, পরমাণু যে কোনও পদার্থের বিভাজ্যতার সীমা যে ভ্রান্ত ধারণাগুলি সম্পূর্ণরূপে ধ্বংস হয়ে গেছে। থমসন কীভাবে ইলেকট্রনের অস্তিত্ব প্রমাণ করতে পেরেছিলেন? তার পরীক্ষায়, বিজ্ঞানী অত্যন্ত বিরল গ্যাসে ইলেক্ট্রোড স্থাপন করেছিলেন এবং একটি বৈদ্যুতিক প্রবাহ পাস করেছিলেন। ফলস্বরূপ, ক্যাথোড রশ্মি উপস্থিত হয়েছিল। থমসন সাবধানতার সাথে তাদের বৈশিষ্ট্যগুলি অধ্যয়ন করেছিলেন এবং আবিষ্কার করেছিলেন যে তারা চার্জযুক্ত কণাগুলির একটি প্রবাহ যা প্রচুর গতিতে চলে। বিজ্ঞানী এই কণার ভর এবং তাদের চার্জ গণনা করতে সক্ষম হন। তিনি আরও আবিষ্কার করেছিলেন যে তারা নিরপেক্ষ কণাতে রূপান্তরিত হতে পারে না, যেহেতু বৈদ্যুতিক চার্জ তাদের প্রকৃতির ভিত্তি। তাই থমসনই ছিলেন পরমাণুর গঠনের বিশ্বের প্রথম মডেলের স্রষ্টা। এটি অনুসারে, একটি পরমাণু হল ধনাত্মক চার্জযুক্ত পদার্থের একটি গুচ্ছ যেখানে নেতিবাচক চার্জযুক্ত ইলেকট্রনগুলি সমানভাবে বিতরণ করা হয়। এই কাঠামোটি পরমাণুর সাধারণ নিরপেক্ষতা ব্যাখ্যা করে, যেহেতু বিপরীত চার্জ একে অপরের ভারসাম্য বজায় রাখে। জন থমসনের পরীক্ষাগুলি পরমাণুর গঠনের আরও অধ্যয়নের জন্য অমূল্য হয়ে ওঠে। তবে অনেক প্রশ্নের উত্তরই থেকে গেল।

রাদারফোর্ডের গবেষণা
থমসন ইলেকট্রনের অস্তিত্ব আবিষ্কার করেছিলেন, কিন্তু তিনি পরমাণুতে ইতিবাচক চার্জযুক্ত কণা খুঁজে পাননি। 1911 সালে এই ভুল বোঝাবুঝি সংশোধন করে। পরীক্ষার সময়, গ্যাসগুলিতে আলফা কণার কার্যকলাপ অধ্যয়ন করার সময়, তিনি আবিষ্কার করেছিলেন যে পরমাণুতে এমন কণা রয়েছে যা ইতিবাচকভাবে চার্জ করা হয়েছিল। রাদারফোর্ড দেখেছিলেন যে যখন রশ্মি গ্যাসের মধ্য দিয়ে বা একটি পাতলা ধাতব প্লেটের মধ্য দিয়ে যায়, তখন অল্প সংখ্যক কণা দ্রুত গতির গতিপথ থেকে বিচ্যুত হয়। তারা আক্ষরিক অর্থেই পিছনে ফেলে দেওয়া হয়েছিল। বিজ্ঞানী অনুমান করেছিলেন যে এই আচরণটি ইতিবাচক চার্জযুক্ত কণাগুলির সাথে সংঘর্ষের দ্বারা ব্যাখ্যা করা হয়েছিল। এই ধরনের পরীক্ষাগুলি পদার্থবিদকে রাদারফোর্ড পরমাণুর কাঠামোর একটি মডেল তৈরি করার অনুমতি দেয়।

গ্রহের মডেল
এখন বিজ্ঞানীর ধারণা জন থমসনের করা অনুমান থেকে কিছুটা ভিন্ন ছিল। তাদের পারমাণবিক মডেলও ভিন্ন হয়ে ওঠে। তাকে এই এলাকায় একটি সম্পূর্ণ নতুন তত্ত্ব তৈরি করার অনুমতি দেয়। পদার্থবিজ্ঞানের আরও উন্নয়নের জন্য বিজ্ঞানীর আবিষ্কারগুলি অত্যন্ত গুরুত্বপূর্ণ ছিল। রাদারফোর্ডের মডেল একটি পরমাণুকে কেন্দ্রে অবস্থিত একটি নিউক্লিয়াস এবং এর চারপাশে ইলেকট্রনগুলিকে ঘোরাফেরা করে বলে বর্ণনা করে। নিউক্লিয়াসের একটি ধনাত্মক চার্জ আছে, এবং ইলেকট্রনের একটি ঋণাত্মক চার্জ আছে। রাদারফোর্ডের পরমাণুর মডেলটি নির্দিষ্ট ট্র্যাজেক্টোরি - কক্ষপথ বরাবর নিউক্লিয়াসের চারপাশে ইলেক্ট্রনগুলির ঘূর্ণন অনুমান করেছিল। বিজ্ঞানীর আবিষ্কার আলফা কণার বিচ্যুতির কারণ ব্যাখ্যা করতে সাহায্য করেছে এবং পরমাণুর পারমাণবিক তত্ত্বের বিকাশের জন্য প্রেরণা হয়ে উঠেছে। রাদারফোর্ডের পরমাণুর মডেলে সূর্যের চারপাশে সৌরজগতের গ্রহগুলির গতিবিধির সাথে একটি সাদৃশ্য রয়েছে। এটি একটি খুব সঠিক এবং প্রাণবন্ত তুলনা। অতএব, রাদারফোর্ডের মডেল, যেখানে পরমাণু একটি কক্ষপথে নিউক্লিয়াসের চারপাশে ঘোরে, তাকে গ্রহ বলা হয়।

নিলস বোহরের কাজ
দুই বছর পরে, ডেনিশ পদার্থবিদ নিলস বোর আলোর কোয়ান্টাম বৈশিষ্ট্যের সাথে পরমাণুর গঠন সম্পর্কে ধারণাগুলি একত্রিত করার চেষ্টা করেছিলেন। বিজ্ঞানী তার নতুন তত্ত্বের ভিত্তি হিসাবে রাদারফোর্ডের পরমাণুর পারমাণবিক মডেল ব্যবহার করেছিলেন। বোহরের মতে, পরমাণু বৃত্তাকার কক্ষপথে নিউক্লিয়াসের চারপাশে ঘোরে। গতির এই গতিপথ ইলেক্ট্রনের ত্বরণের দিকে নিয়ে যায়। উপরন্তু, পরমাণুর কেন্দ্রের সাথে এই কণাগুলির কুলম্ব মিথস্ক্রিয়া ইলেকট্রনের গতিবিধি থেকে উদ্ভূত স্থানিক ইলেক্ট্রোম্যাগনেটিক ফিল্ড বজায় রাখার জন্য শক্তির সৃষ্টি এবং ব্যয়ের সাথে থাকে। এই ধরনের পরিস্থিতিতে, নেতিবাচক চার্জযুক্ত কণাগুলি অবশ্যই একদিন নিউক্লিয়াসে পড়বে। কিন্তু এটি ঘটে না, যা সিস্টেম হিসাবে পরমাণুর বৃহত্তর স্থায়িত্ব নির্দেশ করে। নিলস বোর বুঝতে পেরেছিলেন যে ম্যাক্সওয়েলের সমীকরণ দ্বারা বর্ণিত শাস্ত্রীয় তাপগতিবিদ্যার সূত্রগুলি আন্তঃ-পারমাণবিক অবস্থায় কাজ করে না। অতএব, বিজ্ঞানী নিজেকে নতুন আইন নির্ণয়ের কাজ সেট করেছেন যা প্রাথমিক কণার জগতে বৈধ হবে।

বোহরের অনুমান
মূলত রাদারফোর্ডের মডেলটি বিদ্যমান থাকার কারণে, পরমাণু এবং এর উপাদানগুলি ভালভাবে অধ্যয়ন করা হয়েছিল, নিলস বোর তার পোস্টুলেটগুলি তৈরি করতে সক্ষম হয়েছিলেন। তাদের মধ্যে প্রথমটি বলে যে পরমাণুতে এটি তার শক্তি পরিবর্তন করে না, যখন ইলেকট্রনগুলি তাদের গতিপথ পরিবর্তন না করে কক্ষপথে চলে। দ্বিতীয় অবস্থান অনুসারে, যখন একটি ইলেকট্রন এক কক্ষপথ থেকে অন্য কক্ষপথে চলে যায়, তখন শক্তি নির্গত বা শোষিত হয়। এটি পরমাণুর পূর্ববর্তী এবং পরবর্তী অবস্থার শক্তির মধ্যে পার্থক্যের সমান। তদুপরি, যদি একটি ইলেকট্রন নিউক্লিয়াসের কাছাকাছি একটি কক্ষপথে লাফ দেয়, তবে বিকিরণ ঘটে এবং এর বিপরীতে। ইলেক্ট্রনের গতিবিধি একটি বৃত্তের মধ্যে কঠোরভাবে অবস্থিত একটি কক্ষপথের গতিপথের সাথে সামান্য সাদৃশ্য বহন করে, বোহরের আবিষ্কারটি একই সময়ে, পদার্থবিদ হার্টজ এবং ফ্র্যাঙ্কের অস্তিত্বের জন্য একটি চমৎকার ব্যাখ্যা পাওয়া সম্ভব করে তোলে জার্মানিতে থাকতেন, পরমাণুর স্থির, স্থিতিশীল অবস্থার অস্তিত্ব এবং পারমাণবিক শক্তির মান পরিবর্তনের সম্ভাবনা সম্পর্কে নিলস বোহরের শিক্ষা নিশ্চিত করেছেন।

দুই বিজ্ঞানীর মধ্যে সহযোগিতা
যাইহোক, রাদারফোর্ড দীর্ঘ সময়ের জন্য নির্ধারণ করতে পারেননি বিজ্ঞানী মার্সডেন এবং গিগার আর্নেস্ট রাদারফোর্ডের বিবৃতিগুলি দুবার পরীক্ষা করার চেষ্টা করেছিলেন এবং বিস্তারিত এবং পুঙ্খানুপুঙ্খ পরীক্ষা-নিরীক্ষা এবং গণনার ফলে এই সিদ্ধান্তে পৌঁছেছিলেন যে নিউক্লিয়াস সবচেয়ে বেশি। পরমাণুর গুরুত্বপূর্ণ বৈশিষ্ট্য, এবং এর সমস্ত চার্জ এতে কেন্দ্রীভূত হয়। পরবর্তীকালে, এটি প্রমাণিত হয়েছিল যে পারমাণবিক চার্জের মান ডি.আই. মেন্ডেলিভের উপাদানগুলির পর্যায়ক্রমিক সিস্টেমের উপাদানের সাংখ্যিক সংখ্যার সমান। মজার ব্যাপার হল, নিলস বোর শীঘ্রই রাদারফোর্ডের সাথে দেখা করেন এবং তার মতামতের সাথে সম্পূর্ণ একমত হন। পরবর্তীকালে, বিজ্ঞানীরা একই গবেষণাগারে দীর্ঘকাল একসাথে কাজ করেছিলেন। রাদারফোর্ডের মডেল, প্রাথমিক চার্জযুক্ত কণার সমন্বয়ে একটি সিস্টেম হিসাবে পরমাণু - এই সমস্তই নিলস বোরকে ন্যায্য বলে মনে করেছিলেন এবং তার ইলেকট্রনিক মডেলকে চিরতরে সরিয়ে রেখেছিলেন। বিজ্ঞানীদের যৌথ বৈজ্ঞানিক কার্যকলাপ অত্যন্ত সফল এবং ফলপ্রসূ ছিল। তাদের প্রত্যেকেই প্রাথমিক কণার বৈশিষ্ট্যগুলির অধ্যয়নের দিকে ঝাঁপিয়ে পড়ে এবং আবিষ্কারগুলিকে বিজ্ঞানের জন্য তাৎপর্যপূর্ণ করে তোলে। পরে, রাদারফোর্ড পারমাণবিক পচনের সম্ভাবনা আবিষ্কার করেছিলেন এবং প্রমাণ করেছিলেন, তবে এটি অন্য নিবন্ধের জন্য একটি বিষয়।
পারমাণবিক গঠন
পারমাণবিক পদার্থবিজ্ঞানে চার্জ, ভর এবং শক্তির একক।
সুতরাং, যেকোনো কণার চার্জে সর্বদা প্রাথমিক চার্জের একটি পূর্ণসংখ্যা থাকে। পারমাণবিক আকারের একটি কণার জন্য, এই পূর্ণসংখ্যা সংখ্যাটিও ছোট হবে। এই বিবেচনায়, পারমাণবিক পদার্থবিজ্ঞানে প্রাথমিক চার্জ e = 1.60 10-19 C কে বৈদ্যুতিক চার্জের একক হিসাবে গ্রহণ করা সুবিধাজনক। পারমাণবিক পদার্থবিজ্ঞানে, ভরের একককে কার্বন আইসোটোপ 12C এর একটি পরমাণুর ভরের 1/12 ধরা হয়। এই আইসোটোপের পারমাণবিক ভর হল 12, এবং মোলার ভর M = 12 10-3 kg/mol। সুতরাং, পারমাণবিক ভর একক (a.m.u.) এর সমান
একটি পারমাণবিক ভর একককে পারমাণবিক ভর 1 সহ একটি উপাদানের একটি পরমাণুর ভর হিসাবেও সংজ্ঞায়িত করা যেতে পারে। অতএব, একটি পরমাণুর ভর (আরো সঠিকভাবে, এর গড় মান), পারমাণবিক ভরের ইউনিটে প্রকাশ করা হয়, পারমাণবিক ভরের সমান উপাদানের
মনে রাখবেন যে একটির সমান পারমাণবিক ভর সহ একটি উপাদান প্রকৃতিতে বিদ্যমান নেই। হাইড্রোজেনের পারমাণবিক ভর একতার কাছাকাছি, তবে সামান্য বেশি: এটি 1.008 এর সমান। সুতরাং, সবচেয়ে হালকা পরমাণুর ভর হল 1.008 a। খাওয়া.
পারমাণবিক পদার্থবিজ্ঞানে গৃহীত শক্তির একক হল চার্জ e (উদাহরণস্বরূপ, একটি ইলেকট্রন) দ্বারা 1 V এর সম্ভাব্য পার্থক্যের মধ্য দিয়ে যাওয়ার সময় একটি কণা দ্বারা অর্জিত শক্তি। বৈদ্যুতিক ক্ষেত্রে চলাচলের সময় চার্জ দ্বারা অর্জিত শক্তি চার্জের গুণফল এবং পথের শুরু এবং শেষ বিন্দুর মধ্যে সম্ভাব্য পার্থক্যের সমান, তাই
1 eV=1.6 10-19 C 1V=1.6 10-19J।
ইলেকট্রনভোল্টের সংজ্ঞা থেকে এটি অনুসরণ করে যে একটি সম্ভাব্য পার্থক্য U [V] দ্বারা ত্বরিত একটি ইলেকট্রনের শক্তি সংখ্যাগতভাবে U [eV] এর সমান। 2e চার্জ সহ একটি আয়ন, একই সম্ভাব্য পার্থক্য অতিক্রম করে, 2U [eV], ইত্যাদি শক্তি অর্জন করে।
শুধু চার্জযুক্ত নয়, নিরপেক্ষ কণার শক্তিও ইলেকট্রনভোল্টে পরিমাপ করা যায়। উদাহরণস্বরূপ, আসুন একটি অক্সিজেন পরমাণুর শক্তিকে ইলেক্ট্রন ভোল্টে প্রকাশ করি (m=16 amu) গতি v=103 m/s:
ইলেকট্রনভোল্টের গুণিতক এককগুলিও ব্যবহার করা হয়:
1 keV=103 eV, 1 MeV=106 eV, 1 GeV=109 eV, 1 TeV=1012 eV।
রাদারফোর্ড-বোর পরমাণুর মডেল।
সমস্ত পদার্থ প্রাথমিক কণা নিয়ে গঠিত। কিন্তু পদার্থ সরাসরি প্রাথমিক কণা নিয়ে গঠিত নয়। বিল্ডিং ব্লক বা উপাদান যা থেকে সমস্ত পদার্থ তৈরি করা হয় তা হল পরমাণু। 1912 সাল পর্যন্ত, বিজ্ঞানীরা পরমাণুকে একটি ধনাত্মক চার্জযুক্ত বল হিসাবে উপস্থাপন করেছিলেন যাতে নেতিবাচক চার্জযুক্ত ইলেকট্রন রয়েছে। ইলেক্ট্রন কিশমিশ সহ একটি কাপকেকের মতো নকশাটি থমসন্সের নাম জোসেফ জন এবং উইলিয়াম লর্ড কেলভিন দ্বারা প্রস্তাবিত হয়েছিল।

সাধারণভাবে, এই ধরনের একটি পরমাণুর ধনাত্মক এবং ঋণাত্মক চার্জ ক্ষতিপূরণ দেওয়া হয় এবং পরমাণু বৈদ্যুতিকভাবে নিরপেক্ষ হয়। ধারণা করা হয়েছিল যে একটি পরমাণুর সমগ্র ভর ইলেকট্রনে কেন্দ্রীভূত ছিল। যেহেতু একটি ইলেকট্রন একটি পরমাণুর চেয়ে অনেক হালকা, এমনকি সহজতম পরমাণুতেও হাজার হাজার ইলেকট্রন থাকতে হবে।
1909 সালে, রাদারফোর্ড তৎকালীন তরুণ পদার্থবিজ্ঞানী মার্সডেনকে আলফা রশ্মির বিক্ষিপ্তকরণ অধ্যয়ন করার দায়িত্ব দেন যখন তারা পাতলা ধাতব প্লেটের মধ্য দিয়ে যায়। বেশিরভাগ প্রাথমিক কণা প্লেটগুলির মধ্য দিয়ে যাওয়ার পরে ছোটখাট বিচ্যুতি অনুভব করে। যাইহোক, মার্সডেন খুব শক্তিশালীভাবে বিচ্যুত কণা সনাক্ত করতে সক্ষম হয়েছিল। সত্য, তাদের মধ্যে খুব কমই ছিল, তবে এটি আশ্চর্যজনক যে তারা আদৌ বিদ্যমান ছিল। অবশ্যই, মার্সডেন এটি কল্পনা করতে পারে। আলফা কণা নিবন্ধন করতে, একটি স্পিনথারিস্কোপ ব্যবহার করা হয়েছিল - একটি বিশেষ ফ্লুরোসেন্ট পদার্থের সাথে লেপা একটি ছোট স্বচ্ছ পর্দা। যখন একটি প্রাথমিক কণা এই জাতীয় পর্দায় আঘাত করে, তখন দুর্বল লাঙ্গল ঘটে। ফ্ল্যাশ খুব ছোট এবং দুর্বল. এটি একটি মাইক্রোস্কোপের অধীনে পর্যবেক্ষণ করা হয়। চোখের এটি লক্ষ্য করার জন্য, একজন ব্যক্তিকে অবশ্যই অন্ধকারে অভ্যস্ত হতে হবে। এটি করার জন্য, তিনি কাজ শুরু করার আগে, অর্থাৎ, ফ্ল্যাশগুলি নিবন্ধন এবং গণনা করার আগে, তাকে সম্পূর্ণ অন্ধকারে আধা ঘন্টা বসে থাকতে হবে। তাই মার্সডেনকে ভুল বলাই স্বাভাবিক।
রাদারফোর্ড মার্সডেনকে পরীক্ষা-নিরীক্ষার পুনরাবৃত্তি করতে বলেন, কিন্তু এইবার বিশেষভাবে 90° পর্যন্ত বড় বিচ্যুতি প্রাপ্ত কণাগুলোকে নিরীক্ষণ করেন।
যখন, কয়েকদিন পর, মার্সডেন রাদারফোর্ডের অফিসে ঢুকে বলল, “এমন কণা আছে,” রাদারফোর্ড অবাক হয়ে ফোনটা ফেলে দিল। রাদারফোর্ড, যদিও তিনি মার্সডেনকে এই পরীক্ষাগুলি পরিচালনা করার পরামর্শ দিয়েছিলেন, তিনি নিজেও এমন ফলাফল আশা করেননি।
রাদারফোর্ড পরে স্মরণ করেন: " এটা আমার জীবনের সবচেয়ে অবিশ্বাস্য ঘটনা ছিল. এটি টিস্যু পেপারের টুকরোতে একটি 15 ইঞ্চি শেল গুলি করার এবং শেলটি ফিরে এসে আপনাকে আঘাত করার মতো অবিশ্বাস্য ছিল।".
পরীক্ষাগুলি আবার পরীক্ষা করা হয়েছিল, কিন্তু এবার গেইগার পরীক্ষায় যোগ দিয়েছিলেন। ঘটনাটি পরীক্ষামূলকভাবে অধ্যয়ন করা হয়েছিল এবং পরীক্ষামূলক উপকরণগুলি একই বছরে প্রকাশিত হয়েছিল। যাইহোক, ফলাফলের অর্থ ছিল রহস্যময়। থমসনের পরমাণু একটি আলফা কণাকে উচ্চ গতিতে উড়তে থামাতে পারেনি।
1911 সালে, রাদারফোর্ড তার প্রবন্ধ "দ্যা স্ক্যাটারিং অফ আলফা অ্যান্ড বিটা পার্টিকেলস বাই ম্যাটার অ্যান্ড দ্য স্ট্রাকচার অফ দ্য অ্যাটম" প্রকাশ করেছিলেন, যেখানে তিনি পরমাণুর তার বিখ্যাত গ্রহের মডেলের প্রস্তাব করেছিলেন।

রাদারফোর্ড পরমাণুর কেন্দ্রে অবস্থিত একটি ছোট, খুব বৃহৎ ইতিবাচক চার্জযুক্ত নিউক্লিয়াস, যেখান থেকে আলফা কণাটি বর্ণিত পরীক্ষায় বাউন্স হয়েছে। হালকা নেতিবাচক চার্জযুক্ত ইলেকট্রন নিউক্লিয়াসের চারপাশে ঘোরে। একটি পরমাণুর ভিতরের বেশিরভাগ স্থানই শূন্যতায় ভরা। সামগ্রিকভাবে, মডেলটি আমাদের সৌরজগতের অনুরূপ।
রাদারফোর্ডের বড় আক্ষেপের জন্য, নিবন্ধটি নীরবতার সাথে দেখা হয়েছিল। রাদারফোর্ড অবশ্যই বুঝতে পেরেছিলেন কেন। তার পরমাণু ছিল স্বল্পস্থায়ী। নিউক্লিয়াসের চারপাশে ঘুরতে থাকা একটি ইলেকট্রনকে অবশ্যই ইলেক্ট্রোম্যাগনেটিক তরঙ্গ নির্গত করতে হবে এবং ফলস্বরূপ শক্তি হারাতে হবে। একই সময়ে, এর গতি কমাতে হবে, এবং এটি মূলের উপর পড়তে হবে। যাইহোক, অভিজ্ঞতা দেখায় যে প্রকৃতির প্রায় সমস্ত পরমাণু স্থিতিশীল।
নিলস বোর পরিস্থিতি সংশোধন করেন।
বোহরের তত্ত্ব
বোহরের নীতিগুলি কেপলারের সূত্রের মতো প্রকৃতির, যার মধ্যে তিনটিও রয়েছে। উভয়ই পরীক্ষামূলক তথ্যের ভিত্তিতে প্রাপ্ত অনুমানকৃত নিদর্শন। কেপলারের জন্য এটি সম্ভবত আরও কঠিন ছিল। কিভাবে, উদাহরণস্বরূপ, একজন ফলাফলে পৌঁছাতে পারে যে (সূত্র)? নিউটন মেকানিক্সের সূত্র প্রণয়ন করার পরই কেপলারের সূত্র ব্যাখ্যা করা সম্ভব হয়েছিল।
রাদারফোর্ডের মডেলের প্রধান ত্রুটি ছিল যে একটি নিউক্লিয়াসের চারপাশে একটি বৃত্তাকার কক্ষপথে চলমান একটি ইলেকট্রনকে ইলেক্ট্রোম্যাগনেটিক তরঙ্গ নির্গত করা উচিত, কিন্তু প্রমাণগুলি ইঙ্গিত করে যে এটি তা করে না। রাদারফোর্ড সহ বিজ্ঞানীরা এই দ্বন্দ্বের ব্যাখ্যা দিতে পারেননি। বোহর এটাও করতে পারেনি। তিনি সহজভাবে তথ্যের পক্ষে ছিলেন: যেহেতু ইলেকট্রন নির্গত হয় না, তাই এটি এমন হওয়া উচিত। এইভাবে প্রথম পোস্টুলেটটি প্রকাশিত হয়েছিল। মোট, আমরা ইতিমধ্যে বলেছি, তাদের মধ্যে তিনটি আছে।
বোহরের অনুমান
1. ইলেকট্রন স্থির কক্ষপথে একটি পরমাণুর মধ্যে চলে, যখন তারা শক্তি নির্গত বা শোষণ করে না।
2. স্থির কক্ষপথ হবে সেইগুলি যার জন্য ইলেক্ট্রনের কৌণিক ভরবেগ এমভিআরএকটি পূর্ণসংখ্যা মাল্টিপল সমান।
![]() , যেখানে k = 1, 2, 3, 4...
, যেখানে k = 1, 2, 3, 4...
3. এক কক্ষপথ থেকে অন্য কক্ষপথে যাওয়ার সময়, একটি ইলেকট্রন ফোটন আকারে শক্তি নির্গত বা শোষণ করে।
আরও দূরবর্তী কক্ষপথে থাকার কারণে, একটি ইলেকট্রনের শক্তি বেশি থাকে, তাই, নিউক্লিয়াসের কাছাকাছি একটি কক্ষপথে চলে গেলে, এটি শক্তি সহ একটি ফোটন নির্গত করে

যখন একটি পরমাণু একটি ফোটন শোষণ করে, তখন ইলেকট্রন একটি উচ্চ স্তরে উঠতে পারে।
হাইড্রোজেন পরমাণুর মাত্রা
একটি ইলেক্ট্রন, একটি নিউক্লিয়াসের চারপাশে ঘূর্ণায়মান, এটির দিকে কুলম্ব আকর্ষণের একটি বল অনুভব করে:

পারমাণবিক সংখ্যা Z সহ পারমাণবিক নিউক্লিয়াসের চার্জ কোথায়?
এই বল, নিউটনের দ্বিতীয় সূত্র অনুসারে, সমান হতে হবে, তাই:  বা
বা  .
.
বোহরের দ্বিতীয় সূত্র আমাদের বলে যে কক্ষপথের ব্যাসার্ধ নির্বিচারে হতে পারে না, তবে সমীকরণটি মেনে চলতে হবে:
যেখানে আমরা kth স্থির কক্ষপথ নির্দেশ করব। এখান থেকে আমরা পাই

 .
.
আমরা হাইড্রোজেন Z=1 এর জন্য ক্রমিক নম্বর Z সহ একটি পরমাণুর kth স্থির কক্ষপথের ব্যাসার্ধ পেয়েছি। আসুন আমরা প্রথম (k = 1) অভ্যন্তরীণ কক্ষপথের ব্যাসার্ধটি খুঁজে পাই যেখানে ইলেকট্রনের সর্বনিম্ন পরিমাণ শক্তি রয়েছে।
ফলস্বরূপ, হাইড্রোজেন পরমাণুর ব্যাস প্রায় , যা পরীক্ষামূলক তথ্যের সাথে ভাল চুক্তিতে রয়েছে।
kth কক্ষপথে ইলেকট্রনের শক্তি খুঁজে বের করা যাক।
এর শক্তি কক্ষপথে গতির গতিশক্তি এবং নিউক্লিয়াসের সাথে মিথস্ক্রিয়া সম্ভাব্য ইলেক্ট্রোস্ট্যাটিক শক্তি নিয়ে গঠিত।
>> পরমাণুর গঠন। রাদারফোর্ডের পরীক্ষা
অধ্যায় 12. পারমাণবিক পদার্থবিদ্যা
পরমাণুর জটিল কাঠামোর আবিষ্কার হল আধুনিক পদার্থবিজ্ঞানের বিকাশের সবচেয়ে গুরুত্বপূর্ণ পর্যায়, যা এর আরও বিকাশের উপর তার ছাপ রেখে গেছে। পরমাণুর গঠনের একটি পরিমাণগত তত্ত্ব তৈরি করার প্রক্রিয়ায়, যা পারমাণবিক বর্ণালী ব্যাখ্যা করা সম্ভব করে, মাইক্রো পার্টিকেলগুলির গতির নতুন আইন আবিষ্কৃত হয়েছিল - কোয়ান্টাম মেকানিক্সের আইন।
§ 93 পরমাণুর গঠন। রাদারফোর্ডের পরীক্ষা-নিরীক্ষা
থমসনের মডেল।পরমাণুর গঠন সম্পর্কে বিজ্ঞানীরা তাৎক্ষণিকভাবে সঠিক ধারণা পাননি। পরমাণুর প্রথম মডেলটি ইংরেজ পদার্থবিদ জে জে থমসন দ্বারা প্রস্তাবিত হয়েছিল, যিনি ইলেকট্রন আবিষ্কার করেছিলেন। থমসনের মতে, একটি পরমাণুর ধনাত্মক চার্জ পরমাণুর পুরো আয়তন দখল করে এবং এই আয়তনে একটি স্থির ঘনত্বের সাথে বিতরণ করা হয়। সবচেয়ে সহজ পরমাণু - হাইড্রোজেন পরমাণু - একটি ধনাত্মক চার্জযুক্ত বল যার ব্যাসার্ধ প্রায় 10 -8 সেমি, যার ভিতরে একটি ইলেকট্রন রয়েছে। আরও জটিল পরমাণুর একটি ধনাত্মক চার্জযুক্ত বলের মধ্যে বেশ কয়েকটি ইলেকট্রন থাকে, যাতে পরমাণুটি একটি কাপকেকের মতো যেখানে ইলেকট্রনগুলি কিশমিশ হিসাবে কাজ করে।
যাইহোক, থমসনের পরমাণুর মডেলটি সেই সময়ের মধ্যে ইতিমধ্যে পরিচিত পরমাণুর বৈশিষ্ট্যগুলির সাথে সম্পূর্ণ দ্বন্দ্বে পরিণত হয়েছিল, যার মধ্যে প্রধানটি ছিল স্থায়িত্ব।
রাদারফোর্ডের পরীক্ষা।ইলেকট্রনের ভর পরমাণুর ভরের চেয়ে কয়েক হাজার গুণ কম। যেহেতু পরমাণুটি সামগ্রিকভাবে নিরপেক্ষ, তাই, পরমাণুর ভরের বেশিরভাগ অংশ তার ধনাত্মক চার্জযুক্ত অংশে রয়েছে।
পরীক্ষামূলকভাবে ধনাত্মক চার্জের বন্টন অধ্যয়ন করার জন্য, এবং তাই ভর, একটি পরমাণুর ভিতরে, আর্নেস্ট রাদারফোর্ড 1906 সালে -কণা ব্যবহার করে পরমাণুর প্রোবিং ব্যবহার করার প্রস্তাব করেছিলেন। এই কণাগুলি রেডিয়াম এবং অন্যান্য কিছু উপাদানের ক্ষয় থেকে উদ্ভূত হয়। তাদের ভর একটি ইলেকট্রনের ভরের প্রায় 8000 গুণ, এবং তাদের ধনাত্মক চার্জ ইলেকট্রনের দ্বিগুণ পরিমাণের সমান। এগুলো সম্পূর্ণ আয়নিত হিলিয়াম পরমাণু ছাড়া আর কিছুই নয়। -কণার গতি খুব বেশি: এটি আলোর গতি 1/15।
রাদারফোর্ড এই কণা দিয়ে ভারী মৌলের পরমাণু বোমা মেরেছিল। তাদের কম ভরের কারণে, ইলেক্ট্রনগুলি একটি কণার গতিপথ উল্লেখযোগ্যভাবে পরিবর্তন করতে পারে না, ঠিক যেমন একটি গাড়ির সাথে সংঘর্ষের সময় কয়েক দশ গ্রাম ওজনের একটি নুড়ি তার গতি উল্লেখযোগ্যভাবে পরিবর্তন করতে পারে না।

রাদারফোর্ড আর্নেস্ট (1871 - 1937)- মহান ইংরেজ পদার্থবিদ, নিউজিল্যান্ডের অধিবাসী। তার পরীক্ষামূলক আবিষ্কারের মাধ্যমে তিনি পরমাণুর গঠন এবং তেজস্ক্রিয়তার আধুনিক মতবাদের ভিত্তি স্থাপন করেন। তিনিই প্রথম তেজস্ক্রিয় পদার্থের গঠন অধ্যয়ন করেন। তিনি পারমাণবিক নিউক্লিয়াস আবিষ্কার করেন এবং প্রথমবারের মতো পারমাণবিক নিউক্লিয়াসের কৃত্রিম রূপান্তর করেন। তিনি যে সমস্ত পরীক্ষা-নিরীক্ষা করেছিলেন তা ছিল মৌলিক প্রকৃতির এবং ব্যতিক্রমী সরলতা এবং স্বচ্ছতার দ্বারা আলাদা।
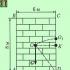
-কণার বিক্ষিপ্তকরণ (চলাচলের দিক পরিবর্তন) শুধুমাত্র পরমাণুর ধনাত্মক চার্জযুক্ত অংশের কারণে হতে পারে। এইভাবে, -কণার বিক্ষিপ্তকরণ থেকে, পরমাণুর ভিতরে ধনাত্মক চার্জ এবং ভর বিতরণের প্রকৃতি নির্ধারণ করা সম্ভব। রাদারফোর্ডের পরীক্ষা-নিরীক্ষার স্কিম চিত্র 12.1-এ দেখানো হয়েছে।
একটি তেজস্ক্রিয় ওষুধ, যেমন রেডিয়াম, একটি সীসা সিলিন্ডার l এর ভিতরে স্থাপন করা হয়েছিল, যার সাথে একটি সরু চ্যানেল ছিদ্র করা হয়েছিল। চ্যানেল থেকে কণার একটি মরীচি অধ্যয়নের অধীনে উপাদান (সোনা, তামা, ইত্যাদি) দিয়ে তৈরি পাতলা ফয়েল 2-এ পড়েছিল। বিক্ষিপ্ত হওয়ার পরে, কণাগুলি জিঙ্ক সালফাইড দিয়ে লেপা একটি স্বচ্ছ পর্দা 3-এ পড়েছিল। পর্দার সাথে প্রতিটি কণার সংঘর্ষের সাথে আলোর ঝলকানি (সিন্টিলেশন) ছিল, যা মাইক্রোস্কোপ 4 এর মাধ্যমে পর্যবেক্ষণ করা যেতে পারে। পুরো ডিভাইসটি একটি পাত্রে স্থাপন করা হয়েছিল যেখান থেকে বায়ু খালি করা হয়েছিল।
ডিভাইসের ভিতরে একটি ভাল ভ্যাকুয়াম এবং ফয়েলের অনুপস্থিতিতে, স্ক্রিনে একটি হালকা বৃত্ত উপস্থিত হয়েছিল, যা কণার একটি পাতলা মরীচি দ্বারা সৃষ্ট সিন্টিলেশন সমন্বিত। কিন্তু যখন বিমের পথে ফয়েল স্থাপন করা হয়েছিল, তখন বিক্ষিপ্ততার কারণে কণাগুলি একটি বৃহত্তর এলাকার একটি বৃত্তের উপর পর্দায় বিতরণ করা হয়েছিল।
পরীক্ষামূলক সেটআপ পরিবর্তন করে, রাদারফোর্ড বৃহৎ কোণে β-কণার বিচ্যুতি সনাক্ত করার চেষ্টা করেছিলেন। এটি করার জন্য, তিনি সিন্টিলেশন স্ক্রিন দিয়ে ফয়েলটিকে ঘিরে রেখেছিলেন এবং প্রতিটি পর্দায় ফ্ল্যাশের সংখ্যা নির্ধারণ করেছিলেন। বেশ অপ্রত্যাশিতভাবে, এটি দেখা গেল যে অল্প সংখ্যক -কণা (দুই হাজারের মধ্যে প্রায় একটি) 90° এর বেশি কোণে বিচ্যুত হয়েছিল। রাদারফোর্ড পরে স্বীকার করেন যে, তার ছাত্রদের বৃহৎ কোণে β-কণার বিক্ষিপ্ততা পর্যবেক্ষণ করার জন্য একটি পরীক্ষা পরিচালনা করার প্রস্তাব দিয়ে, তিনি নিজেও একটি ইতিবাচক ফলাফলে বিশ্বাস করেননি। "এটা প্রায় অবিশ্বাস্য," রাদারফোর্ড বলেছিলেন, "যেন আপনি একটি টিস্যু পেপারের টুকরোতে 15 ইঞ্চি শেল নিক্ষেপ করেছেন এবং শেলটি ফিরে এসে আপনাকে আঘাত করেছে।"

আসলে, থমসনের মডেলের ভিত্তিতে এই ফলাফলের ভবিষ্যদ্বাণী করা অসম্ভব ছিল। একটি পরমাণু জুড়ে বিতরণ করা হলে, একটি ধনাত্মক চার্জ কণাটিকে পিছনে ফেলে দেওয়ার জন্য যথেষ্ট শক্তিশালী বৈদ্যুতিক ক্ষেত্র তৈরি করতে পারে না। কুলম্বের আইন দ্বারা সর্বাধিক বিকর্ষণীয় শক্তি নির্ধারণ করা যেতে পারে:
যেখানে q হল কণার চার্জ; q হল পরমাণুর ধনাত্মক চার্জ; R এর ব্যাসার্ধ; k - আনুপাতিকতা সহগ। একটি অভিন্ন চার্জযুক্ত বলের বৈদ্যুতিক ক্ষেত্রের শক্তি বলের পৃষ্ঠে সর্বাধিক এবং কেন্দ্রের কাছে যাওয়ার সাথে সাথে তা শূন্যে নেমে আসে। অতএব, R ব্যাসার্ধ যত ছোট, কণাগুলিকে বিকর্ষণকারী বল তত বেশি।
পারমাণবিক নিউক্লিয়াসের আকার নির্ধারণ।রাদারফোর্ডবুঝতে পেরেছিলেন যে -কণাটিকে তখনই ফিরিয়ে দেওয়া যেতে পারে যদি পরমাণুর ধনাত্মক চার্জ এবং এর ভর স্থানের খুব ছোট অঞ্চলে কেন্দ্রীভূত হয়। এইভাবে রাদারফোর্ড একটি পারমাণবিক নিউক্লিয়াসের অস্তিত্বের ধারণাটি নিয়ে এসেছিলেন - একটি ছোট দেহ যেখানে প্রায় সমস্ত ভর এবং পরমাণুর সমস্ত ধনাত্মক চার্জ কেন্দ্রীভূত হয়।
চিত্র 12.2 নিউক্লিয়াস থেকে বিভিন্ন দূরত্বে উড়ন্ত আলফা কণার গতিপথ দেখায়।
বিভিন্ন কোণে ছড়িয়ে ছিটিয়ে থাকা কণার সংখ্যা গণনা করে, রাদারফোর্ড নিউক্লিয়াসের আকার অনুমান করতে সক্ষম হন। দেখা গেল যে কোরের ব্যাস 10 -12 -10 -13 সেমি (বিভিন্ন নিউক্লিয়াসের জন্য ব্যাস আলাদা)। পরমাণুর আকার নিজেই 10 -8 সেমি, অর্থাৎ নিউক্লিয়াসের আকারের চেয়ে 10-100 হাজার গুণ বড়। পরবর্তীকালে, নিউক্লিয়াসের চার্জ নির্ধারণ করা সম্ভব হয়েছিল। তবে ইলেকট্রনের চার্জ এক হিসাবে নেওয়া হলে, নিউক্লিয়াসের চার্জ মেন্ডেলিভের পর্যায় সারণীতে প্রদত্ত রাসায়নিক উপাদানের সংখ্যার সমান।
পরমাণুর গ্রহের মডেল।তার পরীক্ষার উপর ভিত্তি করে, রাদারফোর্ড পরমাণুর একটি গ্রহের মডেল তৈরি করেছিলেন। পরমাণুর কেন্দ্রে একটি ধনাত্মক চার্জযুক্ত নিউক্লিয়াস রয়েছে, যেখানে পরমাণুর প্রায় সমগ্র ভর ঘনীভূত। সাধারণভাবে, পরমাণু নিরপেক্ষ। সুতরাং, নিউক্লিয়াসের চার্জের মতো আন্তঃপারমাণবিক ইলেকট্রনের সংখ্যা পর্যায় সারণীতে মৌলের পারমাণবিক সংখ্যার সমান। এটা স্পষ্ট যে ইলেকট্রন পরমাণুর ভিতরে বিশ্রামে থাকতে পারে না, কারণ তারা নিউক্লিয়াসে পড়ে। তারা কেন্দ্রের চারপাশে ঘোরে, ঠিক যেমন গ্রহগুলি সূর্যকে প্রদক্ষিণ করে। ইলেক্ট্রন গতির এই প্রকৃতি নিউক্লিয়াস থেকে কুলম্বের আকর্ষণীয় শক্তির ক্রিয়া দ্বারা নির্ধারিত হয়।
একটি হাইড্রোজেন পরমাণুতে, শুধুমাত্র একটি ইলেকট্রন নিউক্লিয়াসকে প্রদক্ষিণ করে। একটি হাইড্রোজেন পরমাণুর নিউক্লিয়াসে একটি ইলেক্ট্রনের চার্জের সমান একটি ধনাত্মক চার্জ থাকে এবং একটি ভর ইলেকট্রনের ভরের চেয়ে প্রায় 1836.1 গুণ বেশি। এই নিউক্লিয়াসটিকে একটি প্রোটন বলা হয় এবং একটি প্রাথমিক কণা হিসাবে বিবেচিত হতে শুরু করে। একটি হাইড্রোজেন পরমাণুর আকার হল তার ইলেক্ট্রনের কক্ষপথের ব্যাসার্ধ (চিত্র 12.3)।

পরমাণুর একটি সাধারণ এবং চাক্ষুষ গ্রহের মডেলের একটি সরাসরি পরীক্ষামূলক ভিত্তি রয়েছে। -কণার বিক্ষিপ্তকরণের উপর পরীক্ষাগুলি ব্যাখ্যা করা একেবারে প্রয়োজনীয় বলে মনে হয়। কিন্তু এই মডেলের ভিত্তিতে পরমাণুর অস্তিত্ব, এর স্থায়িত্বের সত্যতা ব্যাখ্যা করা অসম্ভব। সর্বোপরি, কক্ষপথে ইলেকট্রন চলাচল ত্বরণের সাথে ঘটে এবং বেশ উল্লেখযোগ্য। ম্যাক্সওয়েলের ইলেক্ট্রোডায়নামিক্সের নিয়ম অনুসারে, একটি ত্বরণশীল চার্জ নিউক্লিয়াসের চারপাশে তার বিপ্লবের কম্পাঙ্কের সমান ফ্রিকোয়েন্সি সহ তড়িৎ চৌম্বকীয় তরঙ্গ নির্গত করা উচিত। বিকিরণ শক্তি হ্রাস দ্বারা অনুষঙ্গী হয়. শক্তি হারালে, ইলেক্ট্রনগুলিকে অবশ্যই নিউক্লিয়াসের কাছে যেতে হবে, ঠিক যেমন একটি উপগ্রহ উপরের বায়ুমণ্ডলে ব্রেক করার সময় পৃথিবীর কাছে আসে। নিউটনিয়ান মেকানিক্স এবং ম্যাক্সওয়েলিয়ান ইলেক্ট্রোডায়নামিক্সের উপর ভিত্তি করে কঠোর গণনা দেখায় যে, একটি ইলেকট্রন অবশ্যই খুব কম সময়ের মধ্যে নিউক্লিয়াসে পড়ে (প্রায় 10-8 সেকেন্ড)। পরমাণুর অস্তিত্ব বন্ধ করতে হবে।
বাস্তবে, এরকম কিছুই ঘটে না। পরমাণু স্থিতিশীল এবং একটি উদ্বেগহীন অবস্থায় অনির্দিষ্টকালের জন্য বিদ্যমান থাকতে পারে, মোটেও ইলেক্ট্রোম্যাগনেটিক তরঙ্গ নির্গত না করে।
উপসংহার, যা অভিজ্ঞতার সাথে অসামঞ্জস্যপূর্ণ, বিকিরণের মাধ্যমে শক্তির ক্ষতির কারণে পরমাণুর অনিবার্য মৃত্যু সম্পর্কে, এটি পরমাণুর অভ্যন্তরে ঘটে যাওয়া ঘটনাগুলিতে শাস্ত্রীয় পদার্থবিজ্ঞানের আইন প্রয়োগের ফলাফল। এটি অনুসরণ করে যে ধ্রুপদী পদার্থবিজ্ঞানের নিয়মগুলি এই জাতীয় ঘটনার জন্য প্রযোজ্য নয়।
রাদারফোর্ড পরমাণুর একটি গ্রহের মডেল তৈরি করেছিলেন: ইলেক্ট্রন নিউক্লিয়াসের চারপাশে প্রদক্ষিণ করে, ঠিক যেমন গ্রহগুলি সূর্যের চারপাশে প্রদক্ষিণ করে। এই মডেলটি সহজ, পরীক্ষামূলকভাবে ন্যায়সঙ্গত, কিন্তু ভলিউমের স্থায়িত্ব ব্যাখ্যা করে না।
1. কেন একটি পরমাণুর ঋণাত্মক চার্জযুক্ত কণা -কণার বিক্ষিপ্ততার উপর লক্ষণীয় প্রভাব ফেলে না!
2. যদি পরমাণুর ধনাত্মক চার্জ তার সমগ্র আয়তন জুড়ে বিতরণ করা হয় তবে কেন - কণাগুলিকে বড় কোণে বিক্ষিপ্ত করা যায় না!
3. কেন পরমাণুর গ্রহের মডেল শাস্ত্রীয় পদার্থবিদ্যার নিয়মের সাথে একমত নয়!
মায়াকিশেভ জি ইয়া, পদার্থবিদ্যা। 11 তম শ্রেণী: শিক্ষাগত। সাধারণ শিক্ষার জন্য প্রতিষ্ঠান: মৌলিক এবং প্রোফাইল। স্তর / জি. ইয়াকিশেভ, বি. ভি. বুখোভতসেভ, ভি. এম. চারুগিন; দ্বারা সম্পাদিত V. I. Nikolaeva, N. A. Parfentieva। - 17 তম সংস্করণ, সংশোধিত। এবং অতিরিক্ত - এম।: শিক্ষা, 2008। - 399 পি।: অসুস্থ।
পদার্থবিদ্যা পাঠের নোটের সংগ্রহ ডাউনলোড, ক্যালেন্ডার এবং বিষয়ভিত্তিক পরিকল্পনা, অনলাইনে সমস্ত বিষয়ের পাঠ্যপুস্তক
পাঠের বিষয়বস্তু পাঠের নোটসমর্থনকারী ফ্রেম পাঠ উপস্থাপনা ত্বরণ পদ্ধতি ইন্টারেক্টিভ প্রযুক্তি অনুশীলন করা কাজ এবং ব্যায়াম স্ব-পরীক্ষা কর্মশালা, প্রশিক্ষণ, কেস, অনুসন্ধান হোমওয়ার্ক আলোচনা প্রশ্ন ছাত্রদের থেকে অলঙ্কৃত প্রশ্ন ইলাস্ট্রেশন অডিও, ভিডিও ক্লিপ এবং মাল্টিমিডিয়াফটোগ্রাফ, ছবি, গ্রাফিক্স, টেবিল, ডায়াগ্রাম, হাস্যরস, উপাখ্যান, কৌতুক, কমিকস, উপমা, উক্তি, ক্রসওয়ার্ড, উদ্ধৃতি অ্যাড-অন বিমূর্তকৌতূহলী cribs পাঠ্যপুস্তক মৌলিক এবং পদ অন্যান্য অতিরিক্ত অভিধান জন্য নিবন্ধ কৌশল পাঠ্যপুস্তক এবং পাঠের উন্নতিপাঠ্যবইয়ে ভুল সংশোধন করাপাঠ্যপুস্তকের একটি টুকরো আপডেট করা, পাঠে উদ্ভাবনের উপাদান, পুরানো জ্ঞানকে নতুন দিয়ে প্রতিস্থাপন করা শুধুমাত্র শিক্ষকদের জন্য নিখুঁত পাঠবছরের জন্য ক্যালেন্ডার পরিকল্পনা; সমন্বিত পাঠএই পাঠের বিষয় হল “পরমাণুর মডেল। রাদারফোর্ডের অভিজ্ঞতা।" এটিতে আমরা শিখব কীভাবে বিজ্ঞানীরা পরমাণুর জটিল গঠন অধ্যয়ন করেছিলেন, কীভাবে তারা এই তত্ত্বের জন্য একটি ব্যাখ্যা খুঁজে পেয়েছেন, যেখানে অর্জিত জ্ঞান আজ প্রয়োগ করা হয়। আমরা রাদারফোর্ডের পরীক্ষা কীভাবে পরমাণুর মডেল অধ্যয়ন করতে ব্যবহার করা যেতে পারে তাও দেখব।
আগের পাঠে, আমরা আলোচনা করেছি যে তেজস্ক্রিয়তা বিভিন্ন ধরনের বিকিরণ তৈরি করে: a-, b- এবং g-রশ্মি। একটি সরঞ্জাম উপস্থিত হয়েছিল যার সাহায্যে পরমাণুর গঠন অধ্যয়ন করা সম্ভব হয়েছিল।
পরমাণুরও একটি জটিল কাঠামো রয়েছে, এটি একটি বিশেষ উপায়ে গঠন করা হয়েছে তা স্পষ্ট হওয়ার পরে, পরমাণুর গঠনটি অনুসন্ধান করা প্রয়োজন ছিল, এটি কীভাবে গঠন করা হয়েছে, এটি কী নিয়ে গঠিত তা ব্যাখ্যা করা প্রয়োজন। আর তাই বিজ্ঞানীরা এই গবেষণা শুরু করেছেন।
জটিল গঠন সম্পর্কে প্রথম ধারণা প্রকাশ করা হয়েছিল থমসন, যিনি 1897 সালে ইলেকট্রন আবিষ্কার করেন। 1903 সালে, থমসন প্রথম পরমাণুর একটি মডেল প্রস্তাব করেন। থমসনের তত্ত্ব অনুসারে, পরমাণুটি তার পুরো আয়তন জুড়ে একটি ধনাত্মক চার্জযুক্ত একটি বল ছিল। এবং ভিতরে, ভাসমান উপাদানের মত, ইলেকট্রন ছিল। সাধারণভাবে, থমসনের মতে, পরমাণুটি বৈদ্যুতিকভাবে নিরপেক্ষ ছিল, অর্থাৎ, এই ধরনের একটি পরমাণুর চার্জ ছিল 0 এর সমান। ইলেকট্রনের ঋণাত্মক চার্জ পরমাণুর ধনাত্মক চার্জের জন্য ক্ষতিপূরণ দেয়। পরমাণুর আকার ছিল প্রায় 10 -10 মিটার থমসনের মডেলটিকে "কিশমিশের সাথে পুডিং" বলা হত: "পুডিং" নিজেই পরমাণুর ইতিবাচক চার্জযুক্ত "বডি" এবং "কিসমিস" হল ইলেকট্রন (চিত্র 1)। )
ভাত। 1. থমসনের পরমাণুর মডেল ("কিশমিশ পুডিং")
পরমাণুর গঠন নির্ধারণের জন্য প্রথম নির্ভরযোগ্য পরীক্ষা চালানো হয়েছিল ই. রাদারফোর্ড. আজ আমরা নিশ্চিতভাবে জানি যে পরমাণু একটি কাঠামো যা একটি গ্রহের সৌরজগতের স্মরণ করিয়ে দেয়। কেন্দ্রে একটি বিশাল দেহ রয়েছে যার চারপাশে গ্রহগুলি ঘুরছে। পরমাণুর এই মডেলটিকে গ্রহের মডেল বলা হয়।
আসুন রাদারফোর্ডের পরীক্ষামূলক চিত্রে (চিত্র 2) ঘুরে আসি এবং সেই ফলাফলগুলি নিয়ে আলোচনা করি যা গ্রহের মডেল তৈরির দিকে পরিচালিত করেছিল।

ভাত। 2. রাদারফোর্ডের পরীক্ষার স্কিম
রেডিয়াম একটি সরু গর্ত সহ একটি সীসা সিলিন্ডারের ভিতরে স্থাপন করা হয়েছিল। একটি ডায়াফ্রাম ব্যবহার করে, একটি-কণার একটি সরু রশ্মি তৈরি করা হয়েছিল, যা, ডায়াফ্রামের খোলার মধ্য দিয়ে উড়ে, একটি বিশেষ রচনার সাথে প্রলেপযুক্ত একটি পর্দায় আঘাত করে, একটি মাইক্রো-ফ্ল্যাশ ঘটেছিল; কণাগুলি যখন স্ক্রিনে আঘাত করে তখন এই আলোকে "সিন্টিলেশন ফ্ল্যাশ" বলা হয়। একটি মাইক্রোস্কোপ ব্যবহার করে পর্দার পৃষ্ঠে এই ধরনের ফ্ল্যাশগুলি পর্যবেক্ষণ করা হয়েছিল। পরবর্তীকালে, যতক্ষণ সার্কিটে সোনার প্লেট ছিল না, সিলিন্ডার থেকে উড়ে আসা সমস্ত কণা এক বিন্দুতে আঘাত করেছিল। একটি কণা উড়ার পথে পর্দার ভিতরে যখন খুব পাতলা সোনার প্লেট স্থাপন করা হয়েছিল, তখন সম্পূর্ণরূপে বোধগম্য জিনিসগুলি পর্যবেক্ষণ করা শুরু হয়েছিল। সোনার প্লেটটি স্থাপন করার সাথে সাথেই ক-কণাগুলি বিচ্যুত হতে শুরু করে। কণাগুলি লক্ষ্য করা গেছে যেগুলি তাদের প্রাথমিক রৈখিক গতি থেকে বিচ্যুত হয়েছে এবং ইতিমধ্যে এই স্ক্রিনের সম্পূর্ণ ভিন্ন পয়েন্টে শেষ হয়েছে।
তদুপরি, যখন স্ক্রিনটি প্রায় বন্ধ করা হয়েছিল, তখন দেখা গেল যে সেখানে কণাগুলি ছিল যা কোনওভাবে বিপরীত দিকে উড়ছিল। তারা 90° বা তার বেশি কোণে বিচ্যুত হয়। এই পর্যবেক্ষণগুলি রাদারফোর্ড দ্বারা বিশ্লেষণ করা হয়েছিল, এবং নিম্নলিখিত বরং আকর্ষণীয় জিনিস আবির্ভূত হয়েছিল।
প্রথমত, থমসনের তত্ত্ব এখানে ব্যর্থ হয়েছে। থমসনের তত্ত্ব অনুসারে, একটি পরমাণু হল 10 -10 মিটার আকারের একটি বল, যার মধ্যে ধনাত্মক চার্জ smeared এবং একটি ইলেকট্রন রয়েছে। সুতরাং, ইলেকট্রনগুলি খুব ছোট কণা; এই ক্ষেত্রে একটি কণার গতি ছিল প্রায় 10,000 কিমি/সেকেন্ড।
এমন একটি পরিস্থিতি কল্পনা করুন যেখানে একটি ট্রাক একটি খেলনা গাড়ির সাথে সংঘর্ষ হয়। এটা স্পষ্ট যে ট্রাকটি এমন একটি গাড়িও লক্ষ্য করবে না। আমরা এটিকে একটি কণার সাথে একটি ইলেকট্রনের সংঘর্ষের সাদৃশ্য হিসাবে দিতে পারি। এর মানে হল যে এই উপসংহারে পৌঁছানো প্রয়োজন ছিল যে পরমাণু ভিন্নভাবে গঠন করা হয়েছে, থমসনের দাবি অনুযায়ী নয়। এবং, স্পষ্টতই, সোনার পরমাণুতে একটি-কণার চেয়ে বেশি বৃহদায়তন একটি বস্তু রয়েছে, যার একটি ইতিবাচক চার্জ রয়েছে।
আসুন আরেকটি ছবি দেখি যা সেই বৃহদায়তন কণার উপর একটি-কণার বিক্ষিপ্তকরণকে চিহ্নিত করে, যার উপস্থিতি রাদারফোর্ড পরমাণুতে ভবিষ্যদ্বাণী করেছিলেন (চিত্র 3)।

ভাত। 3. আলফা কণা বিচ্ছুরণপরীক্ষার ফলাফলের উপর ভিত্তি করে, এটি বলা যেতে পারে যে পরমাণুতে একটি বিশাল ধনাত্মক চার্জযুক্ত বস্তু রয়েছে। এই বৃহৎ কণার সাথে একটি ক-কণার সংঘর্ষ হলে তা প্রতিফলিত হতে পারে। যে কণাগুলি কাছাকাছি উড়ে যায় বিভিন্ন কোণে বিচ্যুত হয়। এই বস্তু থেকে একটি-কণা যত বেশি উড়ে যায়, তত ছোট কোণে তারা বিচ্যুত হয়। এই ঘটনাটিকে বলা হয় " a-কণা বিচ্ছুরণ».
রাদারফোর্ড পরমাণুর ভিতরে থাকা বৃহৎ কণাকে নিউক্লিয়াস বলেছেন। এবং তিনি এমনকি এর আকারের প্রশংসা করেছিলেন। রাদারফোর্ডের মতে, নিউক্লিয়াসের আকার ছিল 10 -14 -10 -15 মিটার এই বস্তুটি একটি পরমাণুর তুলনায় খুব ছোট ছিল। পরমাণুর আকার 10 -10 মিটার এবং পরমাণুর প্রায় পুরো ভর নিউক্লিয়াসে কেন্দ্রীভূত ছিল। আর নিউক্লিয়াসের চারপাশে ইলেকট্রন ঘোরে।
এই থেকেই বোঝা গ্রহ মডেলরাদারফোর্ড, যা বলে যে পরমাণু হল একটি বিশাল ধনাত্মক চার্জযুক্ত নিউক্লিয়াস যার চারপাশে ইলেকট্রনগুলি তাদের কক্ষপথে ঘোরে (চিত্র 4)। সাধারণভাবে, পরমাণু বৈদ্যুতিকভাবে নিরপেক্ষ, অর্থাৎ, পরমাণুর চার্জ শূন্য। যদি একটি পরমাণুতে ইলেকট্রনের অতিরিক্ত বা ঘাটতি থাকে তবে তাকে আয়ন বলে।

ভাত। 4. পরমাণুর গ্রহের মডেল
অবশ্যই, আগ্রহের অন্যান্য তত্ত্ব ছিল। আজ, সাধারণভাবে গৃহীত একটি, কিছু সংরক্ষণের সাথে, যা আমরা পরে আলোচনা করব, আর্নেস্ট রাদারফোর্ড দ্বারা প্রস্তাবিত পরমাণুর গ্রহের মডেল।
গ্রন্থপঞ্জি
- ব্রনস্টেইন এম.পি. পরমাণু এবং ইলেকট্রন। "লাইব্রেরি "Kvant""। ভলিউম 1. - এম.: নাউকা, 1980।
- কিকোইন আই.কে., কিকোইন এ.কে. পদার্থবিদ্যা: উচ্চ বিদ্যালয়ের 9ম শ্রেণীর পাঠ্যপুস্তক। - এম.: "এনলাইটেনমেন্ট"।
- Kitaygorodsky A.I. প্রত্যেকের জন্য পদার্থবিদ্যা। ফোটন এবং নিউক্লিয়াস। বই 4. - এম.: বিজ্ঞান।
- মায়াকিশেভ জি ইয়া।, সিনিয়াকোভা এজেড। পদার্থবিদ্যা। অপটিক্স কোয়ান্টাম পদার্থবিদ্যা। 11 তম শ্রেণী: পদার্থবিদ্যার গভীর অধ্যয়নের জন্য পাঠ্যপুস্তক। - এম.: বাস্টার্ড।
- নিউটন I. প্রাকৃতিক দর্শনের গাণিতিক নীতি। - এম.: নাউকা, 1989।
- রাদারফোর্ড ই. নির্বাচিত বৈজ্ঞানিক কাজ। তেজস্ক্রিয়তা। - এম.: বিজ্ঞান।
- রাদারফোর্ড ই. নির্বাচিত বৈজ্ঞানিক কাজ। পরমাণুর গঠন এবং উপাদানের কৃত্রিম রূপান্তর। - এম.: বিজ্ঞান।
- আইনস্টাইন এ., ইনফেল্ড এল. পদার্থবিজ্ঞানের বিবর্তন। প্রাথমিক ধারণা থেকে আপেক্ষিকতা এবং কোয়ান্টাম তত্ত্বের ধারণার বিকাশ। - এম.: নাউকা, 1965।