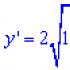Органические соединения. Реакция поликонденсации Вопросы и упражнения
5.3. ПОЛИКОНДЕНСАЦИЯ
Поликонденсация - это реакция образования макромолекул при соединении мономеров между собой, сопровождающаяся отщеплением простых веществ - воды, спирта, аммиака, хлористого водорода и т.п. При поликонденсации протекает ряд кинетически не связанных бимолекулярных реакций. Особенности реакции поликонденсации:
- 1) элементарный состав звена полимера отличается от состава исходного мономера;
- 2) мономерные звенья в молекуле полимера связаны между собой ковалентной или семиполярной связью;
- 3) в результате реакции образуются полимерные цепи различной длины, т.е. продукт полидисперсен;
- 4) поликонденсация - ступенчатый процесс.
Таблица 5.4. Типы соединений, образующихся при поликонденсации, в зависимости от природы функциональных групп
| Первая функциональная группа (а) | Вторая функциональная группа (b) | Исходное вещество | Тип образующегося соединения |
| -H | H- | Углеводород | Полиуглеводород |
| -H | Сl- | Галогенпроизводное | То же |
| -Вr | Вr- | Дигалогенпроизводное | " |
| -ОН | НО- | Многоатомный спирт | Полиэфир простой |
| -OH | HOOC- | Оксикислота | Полиэфир сложный |
| -OH | ROOC- | Эфир оксикислоты | То же |
| -NH 2 | НООС- | Аминокислота | Полиамид |
| -NH 2 | ROOC- | Эфир аминокислоты | То же |
| -NH 2 | СlОC- | Хлорангидрид аминокислоты | " |
В процессе поликонденсации могут участвовать как однородные, так и разнородные молекулы. В общем виде эти реакции изображены следующими схемами:
- х а-А-b → а-(А) х -b + (х - 1)ab;
- х а-А-а + x b-B-b → a-(A-B)-b + 2(х - 1)ab,
где а и b - функциональные группы.
Свойства продукта, образующегося при поликонденсации, определяются функциональностью мономера, т.е. числом реакционноспособных функциональных групп. Реакция поликонденсации может быть использована для синтеза различных классов как карбоцепных, так и гетероцепных полимеров.
При поликонденсации бифункциональных соединений образуются линейные полимеры (табл. 5.4). Если функциональность мономера больше двух, то образуются разветвленные и трехмерные полимеры. Количество функциональных групп в макромолекуле при этом возрастает по мере углубления реакции. Для синтеза волокнообразующих полимеров наибольший интерес представляют бифункциональные соединения.
В зависимости от природы функциональных групп и строения образующегося полимера в реакции поликонденсации могут быть представлены различные классы химических реакций: полиэтерификация, полиангидридизация, полиамидирование и т.д. В табл. 5.5 приведены примеры различных типов соединений, образующихся при поликонденсации.
Взаимодействие функциональных групп мономера может приводить к образованию полимера или низкомолекулярных продуктов циклического строения. Так, например, γ-аминомасляная
Таблица 5.5. Функциональные группы и типы соединений, образующихся при поликонденсации
Таблица 5.5. (продолжение)

Таблица 5.5. (окончание)

кислота неспособна к поликонденсации вследствие образования устойчивого пятичленного цикла - лактама:
Однако ζ-аминоэнантовая кислота образует в результате дегидратации линейный полимер:
Увеличение расстояния между функциональными группами повышает вероятность образования макромолекул. Циклизация как основное направление реакции происходит лишь в тех случаях, когда должны образовываться малонапряженные пяти- и шестичленные циклы.
Вопрос. Глицин (аминоуксусная кислота) в обычных условиях неспособен к конденсации. Объясните вероятную причину этого явления.
Ответ . При взаимодействии двух молекул глицина получается ненапряженный шестичленный дикетипиперазиновый цикл по схеме

При этом в обычных условиях синтеза полимер не образуется.
В зависимости от строения исходных веществ и способа проведения реакции возможны два варианта поликонденсационных процессов: равновесная и неравновесная поликонденсация.
Равновесной поликонденсацией называется такой процесс синтеза полимера, который характеризуется небольшими значениями констант скоростей и обратимым характером превращений. Поликонденсация - многостадийный процесс, каждая ступень которого является элементарной реакцией взаимодействия функциональных групп. В качестве постулата принято считать, что реакционная способность концевых функциональных групп не изменяется при росте полимерной цепи. Процесс равновесной поликонденсации представляет собой сложную систему реакций обмена, синтеза и деструкции, которую называют поликонденсационным равновесием. В общем виде реакции поликонденсации могут быть представлены как реакции функциональных групп, например:
~СООН + НO~ ~СОО~ + Н 2 O.
Соответственно константа равновесия выражается следующим образом:
K n p =
Значение К п p постоянно на всех стадиях поликонденсации, т.е. не зависит от степени полимеризации. Так, для синтеза полиэтилентерефталата при 280°С К п р = 4,9, а полигексаметиленадипамида при 260°С К п р = 305.
Факторы, влияющие на молекулярную массу и полидисперсность поликонденсационных полимеров. Суммарную скорость процесса поликонденсации можно оценить, определяя количество функциональных групп в пробах, отобранных из реакционной смеси через различные промежутки времени. Результат выражается степенью завершенности реакции Х м, которая определяется как доля функциональных групп, прореагировавших к моменту отбора пробы.
Если N 0 - начальное число функциональных групп одного вида, a N t - число групп, не прореагировавших к моменту отбора пробы t , то
Задача. Рассчитать степень завершенности реакций поликонденсации 8-аминокапроновой кислоты, если исходное содержание карбоксильных групп составляло N 0 = 8,5 · 10 -3 экв/г, а конечное - N t = 2,4 · 10 -4 экв/г.
Решение . Схема реакции следующая:
По формуле (5.56) находим, что X м = 0,971.
Для получения полимеров с максимальной молекулярной массой берут мономеры в строго эквивалентных количествах. Каждая функциональная группа одного исходного вещества может при поликонденсации реагировать с функциональной группой другого исходного вещества.
Вместе с тем реакция синтеза полиамидов или сложных полиэфиров обычно катализируется Н + . Процесс протонирования реагирующей карбоксильной группы может быть осуществлен за счет второй группы НООС-. Поэтому скорость реакции между диамином и дикислотой или диолом и дикислотой может быть описана соответственно как
- -dC /dt = K n ;
- -dC /dt = K n [СООН][СООН][ОН].
При условии эквивалентности реагирующих функциональных групп и принимая во внимание, что = [ОН] = [НООС] = С , имеем
где С - концентрация функциональных групп; К п - константа скорости реакции.
После интегрирования при t = 0 и С = С 0 имеем
Задача. Рассчитать константу скорости реакции поликонденсации себациновой кислоты (M 0 = 202) и 2,5-толуилендиамина (M 0 = 122) , если через 40 мин реакции при 260°С концентрация карбоксильных групп составляла N t = 1,7 · 10 -4 экв/г.
Решение . Схема реакции следующая:
n НООС(СН 2) 6 СООН + n H 2 NC 6 H 3 (CH 3)NH 2 HO n H + 2(n - 1)Н 2 О.
Рассчитываем начальную концентрацию карбоксильных групп в исходной смеси, принимая во внимание, что в реакции участвуют 2 моля мономеров:
С 0 = 2/(202 + 122) = 0,61 · 10 -3 экв/г.
По формуле (5.58) определяем константу скорости реакции:
Принимая во внимание, что существенного объема системы при удалении воды не происходит [т.е. можно считать, что С t = C 0 (1 - Х м)], имеем
Задача. Определить константу скорости реакции поликонденсации адипиновой кислоты и этиленгликоля К п и выяснить, изменяется ли она с увеличением размеров молекул реагирующих веществ, если вещества взяты в эквивалентных

Рис. 5.7. Зависимость (1 - X
м) -2 от продолжительности поликонденсации t
количествах и получены следующие значения степени завершенности реакции через определенные промежутки времени:
| t , мин | 20 | 40 | 60 | 120 | 180 |
| Х м | 0,90 | 0,95 | 0,96 | 0,98 | 0,99 |
Решение. Согласно уравнению (5.59), если К п не меняется с изменением размеров реагирующих молекул, то зависимость 1/(1 - X м) 2 = f (t ) должна быть линейной. Строим график зависимости (рис. 5.7), вычислив предварительно значения 1/(1 - Х м) 2:
100; 400; 625; 2500; 1000.
Линейная зависимость (см. рис. 5.7) наблюдается лишь при небольших степенях завершенности реакции. Схема реакции следующая:
По уравнению (5.59) рассчитываем К п для t = 40 мин:
= 5,4 · 10 4 .Суммарную скорость процесса поликонденсации можно описать уравнением
где К п - константа скорости реакции поликонденсации; X м - доля функциональных групп мономера, вступивших в реакцию за время t ; a - количество низкомолекулярного продукта, образовавшегося за время t ; К п p - константа поликонденсационного равновесия.
Чтобы реакция поликонденсации была направлена в сторону образования полимера, количество низкомолекулярного продукта, находящегося в реакционной смеси, должно быть меньше
Задача. Определить константу поликонденсационного равновесия "поликонденсация - гидролиз", если при поликонденсации бензидина и пробковой кислоты за 30 мин доля карбоксильных групп, вступивших в реакцию, составляла 0,84; содержание воды в системе - 0,1 · 10 -3 моль/г; К n = 400; V = 1,3 · 10 -2 моль/(г · мин).
Решение . Схема реакции следующая:
n H 2 N(C 6 H 4) 2 NH 2 + n НООС(СН 2) 6 СООН H n OH + n H 2 O.
K n p =
= 3,3 · 10 -3 .Средняя степень полимеризации продукта поликонденсации зависит от содержания низкомолекулярного продукта реакции, изменяясь в соответствии с уравнением поликонденсационного равновесия, аналогично (6.49). Но
где п а - мольная доля низкомолекулярного продукта, выделяющегося при поликонденсации.
Задача. Определить предельно допустимое остаточное количество этиленгликоля дг в %(мас.) при реакции поликонденсации диэтиленгликольтерефталата в процессе получения полимера с молекулярной массой 20000, если К п р = 4,9.
Решение . Схема реакции следующая:

Р п = 20000/192 = 104.
По формуле (5.61) находим n a :
п а = К n p /Р 2 = 4,9/104 2 = 4,5 · 10 -4 моль/моль,
х = 4,5 · 10 -4 · 62 · 100/192 = 0,008 %(мас.).
Задача. Рассчитать среднечисленную и средневзвешенную молекулярные массы полимера, полученного при поликонденсации 4-амино-2-хлорэтилбензола, если степень завершенности реакции составляла 99,35%. Оценить полидисперсность продукта реакции.
Решение . Легко показать, что
где X м - степень завершенности реакции; М 0 - молекулярная масса мономерного звена.
Схема реакции следующая:
В соответствии с уравнением (1.70)
U = M w /M n - 1 = 1,0.
Если N 0 - начальное число функциональных групп одного вида, то степень завершенности реакции поликонденсации можно выразить следующим образом:
Решение. Схема реакции поликонденсации следующая:
Находим Х м по уравнению (5.64):
Х м = 0,0054 · 436 · 30/(2 + 0,0054 · 436 · 30) = 0,971.
Для вычисления фракционного состава продуктов поликонденсации линейных бифункциональных соединений можно в первом приближении воспользоваться уравнением Флори
где W p - массовая доля фракции полимера со степенью полимеризации Р n .
На рис. 5.8 приведены дифференциальные кривые ММР, характеризующие полидисперсность продуктов поликонденсации при различных степенях завершенности реакции Х м. Очевидно, что по мере увеличения степени превращения исходных полимеров степень полидисперсности возрастает.
Однако в результате реакций, способствующих установлению поликонденсационного равновесия, во многих случаях ММР даже при больших степенях превращения характеризуется сравнительно малыми значениями U (U

Рис.5.8. Дифференциальные кривые ММР, вычисленные по уравнению Флори (5.60) для различных степеней завершенности Х м реакции поликонденсации (числа у кривых)

Решение . Схема реакции синтеза этого полимера следующая:
По уравнению (5.65) рассчитываем W p :
- а) W p = 40 · 0,9 40-1 (1 - 0,9) 2 = 0,065;
- б) W p = 40 · 0,99 40-1 (1 - 0,99) 2 = 0,0034.
Таким образом, по мере углубления реакции содержание фракций с молекулярной массой 9000 уменьшается.
При увеличении содержания в реакционной смеси одного из видов функциональных групп молекулярная масса полимера снижается (рис. 5.9).
Оценка влияния избытка одного из видов функциональных групп в реакционной среде может быть проведена с использованием правила неэквивалентности Коршака. Согласно этому правилу,
где n ’ - число молей бифункционального соединения; т ’ - число молей монофункционального соединения.
Процессы поликонденсации можно проводить в расплаве (если мономеры и полимер достаточно устойчивы при температуре плавления полимера), в растворе, в твердой фазе, а также на поверхности раздела двух фаз (несмешивающиеся жидкости, жидкость - твердое вещество и т.д.). В условиях глубокого вакуума, обеспечивающего удаление низкомолекулярных продуктов реакции, при температуре ниже или выше T пл можно проводить реакцию дополиконденсации (соответственно в твердой или жидкой фазе).
Примеры решения задач
Для получения высокомолекулярных соединений существует два основных способа: полимеризация и поликонденсация.
Полимеризация – реакция соединения молекул мономера, протекающая за счет разрыва кратных связей.
Полимеризацию можно изобразить общей схемой:
где R – заместитель, например, R = H, – СН 3 , Сl, С 6 Н 5 и др.
n – степень полимеризации.
Полимеризация алкадиенов с сопряженными двойными связями (алкадиены-1,3) протекает за счет раскрытия двойных связей в положениях 1,4 или 1,2, например:

Наиболее ценные полимеры (каучуки) получаются при стереорегулярной полимеризации в 1,4-положение в присутствии катализаторов Циглера-Натта :
Для улучшения свойств каучуков полимеризацию бутадиена-1,3 и изопрена проводят совместно со стиролом, акрилонитрилом, изобутиленом. Такие реакции называются сополимеризациями. Например,

где R = – (бутадиен – стирольный каучук),
R = -C º N (бутадиен – нитрильный каучук).
Поликонденсация – реакция образования макромолекул из ди или полифункциональных соединений, сопровождающаяся отщеплением низкомолекулярных продуктов (воды, аммиака, хлорида водорода и др.).
Поликонденсация, в которой участвует только один мономер, называется гомополиконденсацией. Например,
nНО – (СН 2) 6 – СООН (n-1)Н 2 О + Н – [–О – (СН 2) 6 –СО –]n – ОН
7-гидроксигептановая полимер
кислота (мономер)
В результате гомополиконденсации 6-аминогексановой кислоты
(e-аминокапроновой кислоты) получается полимер капрон.
Поликонденсация, в которой участвуют два мономера, содержащие различные функциональные группы, называется гетерополиконденсацией. Например поликонденсация между двухосновными кислотами и двухатомными спиртами приводит к получению полиэфиров:
nНООС – R – COOH + nHO – R¢– OH [– OC – R – COOR¢– O –]n + (2n-1) H 2 O
В результате гетерополиконденсации адипиновой кислоты и гексаметилендиамина получается полиамид (нейлон)
Пример 1.
Сколько структурных звеньев (n) входит в макромолекулу полихлорвинила с молекулярной массой 350000?
M m полимера = 350000
Определить количество структурных звеньев – (n).
1. Схема реакции:

2. Находим молекулярную массу элементарного звена ![]()
сложением атомных масс элементов, входящих в его состав – 62,5.
3. Находим (n). Делим молекулярную массу элементарного звена: 3500: 62,5 = 5600
Ответ: n = 5600
Пример 2.
Напишите схему образования димера и тримера изобутилена под действием серной кислоты с учетом механизма этой реакции (катионной полимеризации).


![]()
Такой процесс полимеризации наблюдал впервые А.М. Бутлеров при действии на изобутилен серной кислоты.
Обрыв цепи в данном случае происходит в результате отщепления протона (Н +).
Реакция идет в присутствии воды, которая захватывает протон, образуя катион гидроксония
Контрольные задания
191. Какие полимеры называют термопластичными, термореактивными?
192. Составьте уравнение реакции сополимеризации стирола
C6H5–CH=CH2и бутадиена СH2=CH–CH=СH2. Какими свойствами обладает продукт сополимеризации и где он используется?
193. Составьте уравнения реакции полимеризации пропилена
СH2=СH–CH3и изобутилена H2C=C–CH3.
194. Напишите уравнение реакции поликонденсации адипиновой кислоты HOOC(СH2)4COOH и гексаметилендиамина NH2(СH2)6NH2. Какой продукт образуется, какими свойствами обладает и где он применяется?
195. Какие углеводороды называются диеновыми? Приведите при-меры. Какой общей формулой выражают состав диеновых углеводородов? Составьте схему полимеризации одного из диеновых углеводородов.
196. Какие соединения называют аминами? Составьте схему поли-конденсации адипиновой кислоты и гексаметилендиамина. Как называют полимер, образующийся в результате этой реакции?
197. Рассчитайте молекулярную массу полихлорвинила, если степень полимеризации равна 200. Напишите уравнение реакции полимеризации хлорвинила.
198. Какие соединения называют аминокислотами? Напишите фор-мулу простейшей аминокислоты. Составьте схему поликонденсации аминокапроновой кислоты. Как называют полимер, образующийся в ре-зультате этой реакции?
199. Напишите уравнения реакций получения капрона из аминока-проновой кислоты NH2(CH2)5COOH и найлона из адипиновой кислоты COOH(CH2)4COOH и гексаметилендиамина NH2(CH2)6NH2.
200. Как называются углеводороды, представителем которых является изопрен? Составьте схему сополимеризации изопрена и изобутилена.
Это кристаллическое вещество с Тпл = 68,5 – 690 С. Хорошо растворим в воде, спирте, эфире и других органических растворителях. Водные растворы кислот вызывают гидролиз до ε - ами-
нокапроновой кислоты. При нагревании до 230 – 2600 С в присутствии небольших количеств воды, спирта, аминов, органических кислот полимеризуется с образованием полиамидной смо-
лы. Является продуктом многотоннажного производства.
ω-Додекалактам (лауринлактам) получается многостадийным синтезом из 1,3-бутадиена.
3 CH2 |
|||||||||||||||||||||||||
Лауринлактам – кристаллическое вещество с Тпл = 153 – 1540 С, хорошо растворимо в спирте, бензоле, ацетоне, плохо в воде. При нагревании полимеризуется в полиамид, однако,
полимеризация протекает хуже, чем у ε-капролактама. (Лауриновая или додекановая кислота – СН3 (СН2 )10 СООН.)
4.2. Методы получения полиамидов Полиамиды относят обычно к группе поликонденсационных полимеров, т.е. полимеров, по-
лучаемых в результате реакций поликонденсации. Подобное отнесение не слишком корректно,
так как полимеры данного типа могут быть получены как поликонденсацией, так и полимери-
зацией мономеров. Поликонденсацией получают полиамиды из ω-аминокарбоновых кислот
(или их эфиров), а также из дикарбоновых кислот (или их эфиров) и диаминов. Основными из полимеризационных методов служит гидролитическая и каталитическая полимеризация лакта-
мов ω-аминокислот. Выбор метода определяется возможностями сырьевой базы и требования-
ми к свойствам соответствующего полиамида.
В промышленности полиамиды получаются четырьмя основными способами:
Гетерополиконденсацией дикарбоновых кислот или их эфиров с органическими диами-
n HOOCRCOOH + n H2 NR"NH2 |
N H2 O |
|||||||||||
- гетерополиконденсацией хлорангидридов дикарбоновых кислот с органическими диа-
- гомополиконденсацией ω-аминокарбоновых кислот (аминокислот) или их эфиров;
N H2 O |
||||||||||
- полимеризацией лактамов аминокислот.
катализатор |
||||||||||||
n (CH2 )n |
HN(CH2 )n CO |
|||||||||||
4.3. Маркировка полиамидов В основу системы маркировки полиамидов положены способ их получения и химическое
строение. Ряд полиамидов, особенно ароматических, имеют собственные названия, установ-
ленные фирмами-производителями.
Для алифатических полиамидов после слова «полиамид» («найлон» в зарубежной литера-
туре) следуют одно или два числа, разделённых запятой (или точкой). Если полиамид синтезирован из одного мономера (аминокислоты или лактама), ставится одно число,
соответствующее числу углеродных атомов в мономере. Например, полиамид, полученный из
ε-капролактама или из ε-аминокапроновой кислоты, обозначается как «полиамид 6»; полимер из аминоэнантовой кислоты – «полиамид 7», полимер из аминоундекановой кислоты -
«полиамид 11». В технической литературе слово «полиамид» нередко заменяется аббревиатурой «ПА» или буквой «П». Тогда вышеприведенные обозначения представляются как «ПА-6», «ПА-11», «П-7». Композиция из двух чисел, разделённых запятой, указывает, что полиамид получен поликонденсацией диамина с дикарбоновой кислотой или её производными.
Число (цифра) до запятой показывает число атомов углерода в диамине; число (цифра) после запятой – число углеродных атомов в использованной кислоте или её производном. Например, «Полиамид 6,6» получен из гексаметилендиамина и адипиновой кислоты; «Полиамид 6,10» -
из гексаметилендиамина и себациновой кислоты. Следует заметить, что запятая (или точка),
разделяющие два числа, могут отсутствовать. Так, Государственным стандартом 10539 – 87
предписывается обозначать полиамид, полученный из гексаметилендиамина и себациновой кислотыВполи, ка кмидах«Полиамид, полученных610». из алифатических аминов и ароматических кислот, линейный структурный элемент обозначается цифрой, показывающей число углеродных атомов в моле-
куле, а звено кислот обозначается начальной буквой их названий. Например, полиамид, по-
лученный из гексаметилендиамина и тере -фталевой кислоты, обозначается как «Полиамид
Названия сополимеров полиамидов составляются из названий отдельных полимеров с ука-
занием в скобках процентного состава (в литературе встречается использование вместо скобок дефиса). Первым указывается тот полиамид, которого в сополимере больше. Например, назва-
ния «Полиамид 6,10/6,6 (65:35)» или «Полиамид 6,10/6,6 - 65/35» означают, что сополимер со-
стоит из 65% полиамида 6,10 и 35 % полиамида 6,6. В ряде случаев используются упрощённые обозначения. Например, запись П-АК-93/7 означает, что сополимер приготовлен из 93 % соли АГ и 7 % ω-капролактама (здесь «А» обозначает соль АГ, «К» – капролактам).
Кроме этих стандартизованных в России обозначений могут в технической и справочной литературе встречаться введённые фирмами собственные имена отдельных типов и марок по-
лиамидов. Например, «Технамид», «Zytel-1147» и другие.

4.4. Производство алифатических полиамидов Из множества синтезированных к настоящему времени полиамидов наибольший практиче-
ский интерес представляют:
Полиамид 6 (поли-ε-капроамид, поликапроамид, капрон, смола капроновая, найлон-6,
капролон В, капролит),
Полиамид 12 (поли-ω-додеканамид),
Полиамид 6,6 (полигексаметиленадипамид, анид, найлон 6,6),
Полиамид 6,8 (полигексаметиленсуберинамид),
Полиамид 6,10 (полигексаметиленсебацинамид),
Полиамиды 6 и 12 получают в технике полимеризацией соответствующих лактамов. Ос-
тальные полиамиды образуются при поликонденсации гексаметилендиамина и диосновных ки-
4.4.1. Полимеризацией лактамов Данным способом получают преимущественно полиамид 6 и полиамид 12.
4.4.1.1. Полиамид 6
Полиамид 6 или поликапроамид получается при полимеризации ε-капролактама в при-
сутствии гидролитических агентов или катализаторов, способствующих раскрытию лактамного цикла. Процесс полимеризации под действием воды называют гидролитической полимериза-
цией. Каталитическая (анионная или катионная) полимеризация ε-капролактама протекает в присутствии щелочных или кислотных катализаторов Основное количество ПА-6 получается гидролитической полимеризацией капролактама.
Гидролитическая полимеризация ε-капролактама протекает под действием воды, раство-
ров кислот, солей или других соединений, вызывающих гидролиз лактамного цикла. Образова-
ние полиамида протекает в две стадии. Химизм процесса можно представить схемой:
H2 N(CH2 )5 COOH |
|||||||||||||||||||||||||||||
HN(CH2 )5 CO |
|||||||||||||||||||||||||||||
Первая стадия процесса – гидролиз капролактама до аминокапроновой кислоты – является наиболее медленной стадией процесса, лимитирующей его общую скорость. Поэтому в произ-
водстве полимеризацию капролактама проводят в присутствии катализаторов. Таковыми чаще всего служат сама аминокапроновая кислота или соль АГ (гексаметиленадипинат, соль ади-
пиновой кислоты и гексаметилендиамина – НООС(СН2 )4 СООН · H2 N(CH2 )6 NH2 ), в которой реагенты находятся в строго эквимолекулярных соотношениях.
Макромолекула образующегося полиамида содержит свободные концевые карбоксильную и аминогруппу, ввиду чего склонна к деструктивным реакциям и дальнейшей поликонденса-
ции при нагревании во время переработки. Для получения более стабильного продукта эти группы могут блокироваться введением в реакционную массу монофункциональных веществ – спиртов, кислот или аминов. Такие соединения, называемые стабилизаторами или регулятора-
ми вязкости, реагируют с концевыми группами и тем стабилизируют полимер, ограничивая его возможности вступать в дальнейшие реакции. Тем самым обеспечивается возможность по-
лучать полимер с заданной молекулярной массой и вязкостью изменением количества стабили-
затора. В качестве стабилизатора часто применяются уксусная и бензойная кислоты.
Гидролитическая полимеризация – процесс обратимый и равновесное состояние зависит от температуры. При проведении реакции в интервале температур 230 – 2600 С содержание мо-
номера и олигомеров в образующемся полиамиде составляет 8 – 10%. При таких температурах все реагенты и полиамид способны активно окисляться кислородом воздуха. Поэтому процесс проводится в инертной атмосфере сухого азота с высокой степенью очистки.
Процесс полимеризации может оформляться по периодической или непрерывной схемам с использованием оборудования разной конструкции. На рис. 3 представлена схема получения ПА 6 непрерывным способом в реакторе колонного типа. Технологический процесс складыва-
ется из стадий подготовки сырья, полимеризации ε-капролактама, охлаждения полимера, его измельчения, промывки и сушки.
Подготовка сырья заключатся в плавлении капролактама при 90 – 1000 С в отдельном аппа-
рате 3 при перемешивании. В аппарате 6 готовится 50 %-ый водный раствор соли АГ. Приго-
товленные жидкости дозировочными насосами 1 и 4 непрерывно подаются через фильтры 2 и 5
в верхнюю часть реактора 7 (колонна высотой около 6 м с горизонтальными перфорированны-
ми металлическими перегородками, способствующими турбулизации потока реагентов при их движении сверху вниз). Реактор обогревается через секции рубашек динилом (эвтектической смесью дифенила и дифенилового эфира). Температура в средней части колонны около 2500 С,
в нижней – до 2700 С. Давление в колонне (1,5 – 2,5 МПа) обеспечивается подачей азота и па-
рами образующейся воды.
Полимеризация начинается сразу после смешения компонентов. Выделяющаяся при реак-
ции и введённая с солью АГ вода испаряется. Её пары, поднимаясь по колонне, способствуют турбулизации и перемешиванию реакционной массы и увлекают с собой пары капролактама.
По выходе из колонны смесь паров последовательно поступает в обратные холодильники 8
и 9. В первом конденсируется капролактам, возвращающийся в колонну. Сконденсировавшие-
ся во втором пары воды выводятся на очистку. Конверсия мономера в колонне около 90%.

Капролактам |
||
на очистку |
Рис. 3. Схема производства полиамида 6 (поликапроамида) непрерывным методом:
1, 4 - дозировочные насосы; 2, 5 - фильтры; 3 - плавитель капролактама; 6 - аппарат растворениясоли АГ; 7 - колонна-реактор; 8, 9, - холодильники; 10 - резательный станок; 11 - промыватель-экстрактор; 12 - фильтр; 13 - вакуум-сушилка; 14 - вращающийся поливочный барабан.
Образовавшийся расплавленный полимер выдавливается через щелевую фильеру в ко-
нической нижней части колоны в виде ленты на холодную поверхность вращающегося в про-
точной воде поливочного барабана 14, охлаждается и с помощью направляющих и тянущих валков поступает на измельчение в резательный станок 10. Полученная крошка полимера для отделения от остатков мономера и олигомеров промывается горячей водой в промывателе-
экстракторе 11. Содержание низкомолекулярных соединений после промывки составляет менее
1,5 %. Промытая крошка отделяется от воды на фильтре 12 и высушивается в вакуум-сушилке
13 при 125 – 1300 С до содержания влаги не более 0,2 %.
Анионная полимеризация ε-капролактама может проводиться в растворе или расплаве мо-
номера при температурах ниже температуры плавления полимера.
катализатор |
||||||||||||
n (CH2 )5 |
HN(CH2 )5 CO |
|||||||||||
Полимеризация проводится в присутствии каталитической системы, состоящей из смеси ка-
тализатора и активатора. Катализаторами могут служить щелочные металлы, их гидрооксиды,
карбонаты, другие соединения. В технике используется, в основном, натриевая соль ε - капро-
лактама, образующаяся при взаимодействии натрия с лактамом.
(CH2 )5 |
1/2 H2 |
||||||||||
N - Na+ |
|||||||||||

Эта соль легко реагирует с лактамом с образованием N- ацилпроизводного, которое при- |
|||||||
соединяется к лактаму, давая начало полиамидной цепи и оставаясь на её конце до полного из- |
|||||||
расходования мономера. |
|||||||
(CH2 )5 |
(CH2 )5 |
(CH2 )5 |
|||||
N - Na+ |
|||||||
N-CO-(CH2 )5 - NH |
|||||||
Активаторы (сокатализаторы) способствуют ускорению прохождения реакции. В их каче- |
|||||||
стве используются N-ацилпроизводные лактама или соединения, способные ацилировать лак- |
|||||||
там в условиях полимеризации (ангидриды карбоновых кислот, эфиры, изоцианаты и др.). Под |
|||||||
влиянием такой системы полимеризация ε-капролактама протекает без индукционного периода |
|||||||
при атмосферном давлении и заканчивается при 140 – |
|||||||
1800 С за 1 – 1,5 часа с конверсией мономера 97 – 99 %. |
Капролактам |
||||||
Столь «мягкие» условия и быстрота полимеризации |
|||||||
позволяют осуществлять её не в реакторах, а в формах, |
|||||||
имеющих конфигурацию и размеры будущих изделий. |
|||||||
Другим плюсом анионной полимеризации является |
|||||||
возможность получения полиамидов с равномерно раз- |
капролактам |
||||||
витой сферолитной структурой, без усадочных рако- |
|||||||
вин, пор, трещин и других дефектов. |
|||||||
Способ анионной полимеризации ε-капролактама в |
|||||||
расплаве в присутствии натриевой соли ε-капролактама |
|||||||
и активатора получил название «скоростная полимери- |
|||||||
зация», а образующийся при этом полимер назван ка- |
В термошкаф |
||||||
пролитом или капролоном В. Используется также на- |
производства капролита: |
||||||
1 - дозировочный насос; 2 - реактор приго- |
|||||||
звание «полиамид блочный» Присвоение собственного |
товления натриевой соли капролактама; 3 - |
||||||
фильтр; 4 - плавитель; 5 - смеситель капро- |
|||||||
наименования получаемому этим способом поли-ε- |
лактама с N- ацетилкапролактамом; 6 - до- |
||||||
зировочный насос; 7 - смеситель; 8 - форма |
|||||||
капроамиду, объясняется тем, что капролон В, имея то же химическое строение, что и поли- |
|||||||
амид 6, заметно отличается от него свойствами. Он проявляет (таблица 5) более высокие проч- |
|||||||
ность, твёрдость, теплостойкость, имеет меньшее водопоглощение и пр. |
Объясняется это, во- |
||||||
несколько большей молекулярной массой капролита, во-вторых – более упорядочен- |
|||||||
ной структурой. Получение капролона В включает (рис. 4) |
стадии подготовки сырья, смеше- |
||||||
ния компонентов и полимеризации. |
На стадии подготовки сырья капролактам плавится и |
||||||
тщательно высушивается при отрицательном давлении в атмосфере азота в аппарате ёмкост- |
|||||||
ного типа с мешалкой 4. |
Половина этого расплава после фильтрования смешивается в аппа- |
||||||
с расчётным количеством металлического натрия для приготовления натриевой соли |
|||||||
ε-капролактама, а другая половина – в аппарате 5 смешивается с сокатализатором (N - аце- |
|||||||
тилкапролактамом). Оба расплава (раствора) с температурой 135 – 140 0 С дозируются насоса-
ми 1 и 6 в нужных соотношениях в быстродействующий смеситель 7, откуда смесь поступает в заливочные формы, вместимость которых может достигать 0,4 – 0,6 м3 . Заполненные формы устанавливаются на 1,0 – 1,5 часа в термошкафы для полимеризации при постепенном повыше-
нии температуры от 140 до 1800 С. Затем формы с полимером медленно охлаждают до комнат-
ной температуры и из них извлекают отливки полимера. В отмывке от мономера необходимо-
сти здесь нет, так как его содержание не превышает 1,5 – 2,5 %.
Применяется скоростная полимеризация ε-капролактама для получения крупногабаритных и толстостенных или нестандартных готовых изделий, а также отливок, изделия из которых готовят механической обработкой.
4.4.1.2. Полиамид 12
Полиамид 12 (поли-ω-додеканамид или найлон 12) получают в промышленности методами
гидролитической и анионной полимеризации ω-додекалактама.
N H2 O |
||||||||||||||||||||
Гидролитическая полимеризация проводится в присутствии воды и кислоты (адипиновой,
орто-фосфорной). Технология получения найлона 12 этим способом подобна технологии синтеза полиамида 6. Свойства полиамида 12 приведены в таблице 5.
Анионная полимеризация ω-додекалактама также подобна таковой для ε-капролактама.
При более низких температурах образуется полимер с большей молекулярной массой, более равномерно развитой сферолитной структурой и, как следствие, с повышенными физико-
механическими свойствами.
4.4.2. Поликонденсацией гексаметилендиамина и дикарбоновых кислот Полиамиды из дикарбоновых кислот и диаминов или из аминокислот получаются методом
равновесной поликонденсации. Для синтеза полимера с высокой молекулярной массой необхо-
димо выполнять несколько главных условий. Одно из них обусловлено обратимостью реакций поликонденсации. Из-за этого образование достаточно высокомолекулярного полимера воз-
можно только при своевременном и полном удалении воды, что достигается проведением про-
цесса в вакууме или при непрерывном токе через реакционную массу сухого инертного газа.
Кроме того, следует учитывать, что по мере прохождения реакции уменьшаются концентрации реагирующих веществ и скорость процесса. Типовым приёмом повышения скорости реакций является увеличение температуры. Однако, выше 3000 С полиамиды начинают заметно разла-
гаться. Поэтому для достижения достаточной конверсии приходится увеличивать продолжи-
тельность контакта реагентов. Таким образом, молекулярная масса получающихся полиамидов может регулироваться в ходе их образования продолжительностью процесса.

Помимо температурного и временного факторов для получения высокомолекулярного по-
лиамида требуется обеспечение строгой эквимолекулярности реагентов. Избыток одного из них даже в пределах 1 % влечёт образование цепей полимера, на концах которых будут нахо-
диться одинаковые функциональные группы избыточного реагента. При избытке диамина концевыми группами будут группы NH2 , а при избытке кислоты – группы СООН. Это приведёт к прекращению реакции роста цепи. Достигается эквимолекулярность использованием для по-
ликонденсации не самих кислот и диаминов, а их кислых солей. Получение таких солей явля-
ется самостоятельной стадией процессов синтеза полиамидов поликонденсацией. Использова-
ние для поликонденсации солей имеет ещё ряд преимуществ: соли нетоксичны, легко кристал-
лизуются, практически не изменяют, в отличие от диаминов, свойства при длительном хране-
нии, не требуют особых условий хранения.
Обеспечение эквимолекулярности реагентов должно было бы теоретически привести к об-
разованию полимера с бесконечно большой молекулярной массой. Однако в промышленной практике ввиду неизбежных потерь части реагентов и прохождения побочных реакций, в кото-
рые могут вступать функциональные группы, молекулярная масса полимеров находится в пределах 10 000 – 50 000.
4.4.2.1. Полиамид 6,6
Полиамид 6,6 (полигексаметиленадипамид, П-66, найлон 6,6, анид) образуется при поли-
конденсации гексаметилендиамина и адипиновой кислоты.
HN(CH) NHCO(CH) CO |
N H2 O |
||||||||||||||
.... .... .......... |
|||||||||||||||
... . |
|||||||||||||||
. . ... .. . ... .. .... .. |
|||||||||||||||
горячий... .. .. ...... ..... . .... ............. |
|||||||||||||||
. .. ................................ . |
|||||||||||||||
..... .. |
|||||||||||||||
...... . |
|||||||||||||||
..... .... |
холодный |
||||||||||||||
Полиамид |
|||||||||||||||
Рис.5. Схема производства полигексаметилендиадимамида (полиамида 6.6):
1 - центрифуга; 2 - аппарат выделения соли из раствора; 3 - аппарат получения соли; 4 - автоклавреактор; 5 - холодильник; 6 - сборник конденсата; 7 - резательный станок; 8 - сушилка; 9 - охлаждающая ванна
Первой стадией процесса является синтез соли адипиновой кислоты и гексаметилендиами-
на (соли АГ). Раствор соли образуется в обогреваемом аппарате 3 при смешении 20 %-ного ме-
танольного раствора адипиновой кислоты с 50 – 60 %-ым раствором гексаметилендиамина в метаноле. В аппарате 2 при охлаждении массы из раствора выделяется плохо растворимая в метаноле соль АГ. Её кристаллы отделяют от маточной жидкости на центрифуге 1, сушат и ис-
пользуют для поликонденсации. Соль - белый кристаллический порошок с Тпл = 190 – 1910 С,
легко растворима в воде, стабильна при хранении в сухом виде и в виде водных растворов.
Процесс синтеза полиамида 6,6 из соли АГ мало чем отличается от процесса полимериза-
ции ε-капролактама. Наиболее существенная особенность - повышенная температура поликон-
денсации. Оптимальная скорость реакции достигается при 270 – 2800 С. При этом реакция протекает практически до конца и по достижении равновесия образуется полимер, содержащий менее 1 % мономеров и низкомолекулярных соединений. Молекулярно-массовое распределение довольно узкое. Причиной отсутствия значительной полидисперсности являются побочные де-
структивные процессы, проходящие под воздействием температуры и низкомолекулярных фракций. В первую очередь деструкции подвергаются высокомолекулярные фракции. Для бо-
лее активного ограничения наличия их в товарном полимере в реакционную массу добавляют-
ся монофункциональные соединения, способные реагировать с концевыми группами полиами-
да. Как и при синтезе полиамида 6, такими соединениями-стабилизаторами (регуляторами вяз-
кости) могут быть уксусная, бензойная кислоты. Это соединения не только ограничивают моле-
кулярную массу полимера при его образовании, но и способствуют постоянству вязкости рас-
плава полимера при его переработке, т.е. при повторном плавлении, которое может вызвать продолжение поликонденсации.
Поликонденсация проводится в автоклаве под давлением 1,5 – 1,9 МПа в атмосфере азота.
В автоклав 4 загружается соль АГ, добавка уксусной кислоты (0,1 – 0,2 моля на моль соли) и
аппарат через рубашку нагревается динилом до 2200 С. Далее, в течение 1,5 – 2-х часов тем-
пература плавно поднимается до 270 – 2800 С. Затем давление уменьшается до атмосферного и после непродолжительной выдержки вновь поднимается. Такие изменения давления повторя-
ются несколько раз. При снижении давления образовавшаяся при поликонденсации вода вски-
пает и её пары дополнительно перемешивают расплав полимера. Выходящие из автоклава пары воды конденсируются в холодильнике 5, собираются в сборнике 6 и выводятся в системы очи-
стки сточных вод. По окончании процесса (6 – 8 часов) остатки воды удаляются под вакуумом,
а расплав полиамида из аппарата через фильеру выдавливается в виде ленты в ванну 9 с про-
4.4.2.2. Полиамиды 6,8 и 6,10
Эти полиамиды получают поликонденсацией гексаметилендиамина и соответствующих ки-

слот (субериновой и себациновой) по технологиям, аналогичным технологии производства по-
лиамида 6,6.
Кислоты и диамин вводятся в реакцию в форме их солей.
Практический интерес из этих полиамидов представляет пока только полиамид 610, по-
скольку производство субериновоой кислоты ограничено его сложностью.
Свойства полиамидов 6.8 и 6.10 приведены в таблице 5.
Подобным же образом производятся смешанные полиамиды, когда в поликонденсацию вводятся различные компоненты, например, соли АГ и капролактам, соли АГ, СГ и капролак-
4.4.3. Поликонденсация диаминов и хлорангидридов дикарбоновых кислот
Данный метод не получил широкого распространения в промышленности ля алифатических полиамидов из-за повышенной стоимости хлорангидридов карбоновых кислот. Тем не менее,
он является единственным для синтеза большинства ароматических полиамидов, в частности фенилона и кевлара.
4.5. Свойства и применение алифатических полиамидов Алифатические полиамиды - твёрдые рогоподобные продукты от белого до светло - кре-
мового цвета, плавящиеся в узком температурном интервале (таблица 5). Узкие интервалы зна-
чений температур плавления свидетельствуют о малой полидисперсности и высокой концен-
трации в полимерах кристаллической фазы. Её содержание может достигать 60 – 80 % и зави-
сит от строения макромолекул. Наибольшей кристалличностью обладают регулярные алифати-
ческие гомополиамиды, отличительной особенностью которых является содержание в макро-
молекуле радикалов только одной кислоты и одного диамина. Таковы, например, полиамид 6,
полиамид 6,6, полиамид 6,10. На степень кристалличности материала в изделиях влияют усло-
вия его переработки, режим термообработки, содержание влаги и специальных добавок. Сте-
пень кристалличности смешанных (полученных из двух или более мономеров) полиамидов меньше. Они менее прочны, но обладают повышенной эластичностью, прозрачны.
Высокие значения температур плавления полиамидов объясняются сильными водородными связями между макромолекулами. Число этих связей прямо зависит от числа амидных групп в макромолекуле и, следовательно, находится в обратной зависимости от числа метиленовых группировок. Водородные связи определяют в значительной мере и все другие свойства. От-
сюда: соотношение метиленовых и амидных групп влияет и на растворимость, и на водостой-
кость, и на физико-механические, и на прочие показатели.
Задание 433
Какие соединения называют аминами? Составьте схему поликонденсации адипиновой кислоты и гексаметилендиамина. Назовите образовавшийся полимер.
Решение:
Аминами
называются производные углеводородов,
образованные замещением в последних атомов водорода на группы -NH 2 , -NHR или -NR"
:
В зависимости от числа атомов водорода у атома азота, замещённых радикалами (R ), амины называются первичными, вторичными или третичными.
Группа -NH 2 , входящая в состав первичных аминов, называется аминогруппой. Группа атомов >NH во вторичных аминах называется иминогруппой .
Схема поликонденсации адипиновой кислоты и гексаметилендиамина :

Анид (найлон ) – продукт поликонденсации адипиновой кислоты и гексаметилендиамина .
Задание 442
Какие соединения называют аминокислотами? Напишите формулу простейшей аминокислоты. Составьте схему поликонденсации аминокапроновой кислоты. Как называют образующийся при этом полимер?
Решение:
Аминокислотами
называются соединения, в молекуле которых содержатся одновременно аминные
(-NH2) и карбоксильные группы
(-СООН). Простейшим представителем их является аминоуксусная кислота
(глицин
): NH2-CH2-COOH.
Схема поликонденсации аминокапроновой кислоты:

Продукт поликонденсации аминокапроновой кислоты называется капрон (перлон ). Из капрона получают волокна, превосходящие по прочности натуральные. Эти волокна применяются в производстве одежды, корда авто- и авиапокрышек, для изготовления прочных и не гниющих рыболовецких сетей и снастей, канатной продукции и т.д.