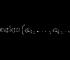Классическая модель атома по Резерфорду. Опыты Резерфорда
Стали важным шагом в развитии физики. Огромное значение имела модель Резерфорда. Атом как система и частицы, его составляющие, был изучен более точно и подробно. Это привело к успешному становлению такой науки, как ядерная физика.
Античные представления о строении вещества
Предположение о том, что окружающие тела состоят из мельчайших частиц, были высказаны еще в античные времена. Мыслители того времени представляли атом в виде мельчайшей и неделимой частицы любого вещества. Они утверждали, что нет во Вселенной ничего меньшего по размеру, чем атом. Таких взглядов придерживались великие древнегреческие ученые и философы - Демокрит, Лукреций, Эпикур. Гипотезы этих мыслителей сегодня объединены под названием «античный атомизм».
Средневековые представления
Времена античности прошли, и в средние века также были ученые, которые высказывали различные предположения о строении веществ. Однако преобладание религиозных философских взглядов и власть церкви в тот период истории на корню пресекали любые попытки и стремления человеческого разума к материалистическим научным выводам и открытиям. Как известно, средневековая инквизиция весьма недружелюбно вела себя с представителями научного мира того времени. Остается сказать, что у тогдашних светлых умов было пришедшее из античности представление о неделимости атома.
Исследования 18-19 веков
18 столетие было отмечено серьезными открытиями в области элементарного строения вещества. Во многом благодаря стараниям таких ученых, как Антуан Лавуазье, Михаил Ломоносов и Независимо друг от друга они сумели доказать, что атомы действительно существуют. Но вопрос об их внутреннем строении оставался открытым. Конец 18 века был отмечен таким знаменательным событием в научном мире, как открытие Д. И. Менделеевым периодической системы химических элементов. Это стало по-настоящему мощным прорывом того времени и приоткрыло завесу над пониманием того, что все атомы имеют единую природу, что они родственны друг другу. В дальнейшем, в 19 веке, еще одним важным шагом на пути к разгадке строения атома стало доказательство того, что в составе любого из них присутствует электрон. Работа ученых этого периода подготовила благодатную почву для открытий 20-го века.

Эксперименты Томсона
Английский физик Джон Томсон в 1897 году доказал, что в состав атомов входят электроны с отрицательным зарядом. На этом этапе ложные представления о том, что атом - предел делимости любого вещества, были окончательно разрушены. Как же Томсон сумел доказать существование электронов? Ученый в своих опытах помещал в сильно разреженные газы электроды и пропускал электрический ток. В результате возникали катодные лучи. Томсон тщательно изучил их особенности и обнаружил, что они являются потоком заряженных частиц, которые движутся с огромной скоростью. Ученый сумел высчитать массу этих частиц и их заряд. Он также выяснил, что их нельзя преобразовать в нейтральные частицы, поскольку электрический заряд - это основа их природы. Так были Томсон является и создателем первой в мире модели строения атома. Согласно ей, атом - это сгусток положительно заряженной материи, в которой равномерно распределены отрицательно заряженные электроны. Такое строение объясняет общую нейтральность атомов, так как противоположные заряды уравновешивают друг друга. Опыты Джона Томсона стали неоценимо важными для дальнейшего изучения строения атома. Однако многие вопросы оставались без ответа.

Исследования Резерфорда
Томсон открыл существование электронов, но он не сумел найти в атоме положительно заряженных частиц. исправил это недоразумение в 1911 году. Во время экспериментов, изучая активность альфа-частиц в газах, он обнаружил, что в атоме присутствуют частицы, положительно заряженные. Резерфорд увидел, что при прохождении лучей сквозь газ или через тонкую металлическую пластину происходит резкое отклонение незначительного количества частиц от траектории движения. Их буквально отбрасывало назад. Ученый догадался, что такое поведение объясняется столкновением с положительно заряженными частицами. Такие эксперименты позволили физику создать модель строения атома Резерфорда.

Планетарная модель
Теперь представления ученого несколько отличались от предположений, высказанных Джоном Томсоном. Разными стали и их модели атомов. позволил ему создать совершенно новую теорию в этой области. Открытия ученого имели решающее значение для дальнейшего развития физики. Модель Резерфорда описывает атом как ядро, расположенное в центре, и движущиеся вокруг него электроны. Ядро обладает положительным зарядом, а электроны - отрицательным. Модель атома по Резерфорду предполагала вращение электронов вокруг ядра по определенным траекториям - орбитам. Открытие ученого помогло объяснить причину отклонения альфа-частиц и стало толчком к развитию ядерной теории атома. В модели атома Резерфорда прослеживается аналогия с движением планет Солнечной системы вокруг Солнца. Это очень точное и яркое сравнение. Поэтому модель Резерфорда, атом в которой движется вокруг ядра по орбите, была названа планетарной.

Работы Нильса Бора
Двумя годами позже датский физик Нильс Бор попытался объединить представления о строении атома с квантовыми свойствами светового потока. Ядерная модель атома Резерфорда была положена ученым в основу его новой теории. По предположению Бора, атомы вращаются вокруг ядра по круговым орбитам. Такая траектория движения приводит к ускорению электронов. Кроме того, кулоновское взаимодействие этих частиц с центром атома сопровождается созданием и расходованием энергии для поддержания пространственного электромагнитного поля, возникающего из-за движения электронов. При таких условиях отрицательно заряженные частицы должны когда-нибудь упасть на ядро. Но этого не происходит, что указывает на большую устойчивость атомов как систем. Нильс бор понял, что законы классической термодинамики, описанные уравнениями Максвелла, не работают во внутриатомных условиях. Поэтому ученый поставил перед собой задачу вывести новые закономерности, которые были бы справедливы в мире элементарных частиц.

Постулаты Бора
Во многом благодаря тому, что существовала модель Резерфорда, атом и его составляющие были неплохо изучены, Нильс Бор смог подойти к созданию своих постулатов. Первый из них гласит о том, что атом имеет при которых он не изменяет свою энергию, а электроны при этом движутся по орбитам, не меняя своей траектории. Согласно второму постулату, при переходе электрона с одной орбиты на другую происходит выделение или поглощение энергии. Она равна разности энергий предшествующего и последующего состояний атома. При этом, если электрон перепрыгивает на более близкую к ядру орбиту, то происходит излучение и наоборот. Несмотря на то что движение электронов мало напоминает орбитальную траекторию, расположенную строго по окружности, открытие Бора позволило получить великолепное объяснение существованию линейчатого спектра Приблизительно в это же время ученые-физики Герц и Франк, жившие в Германии, подтвердили учение Нильса Бора о существовании стационарных, стабильных состояний атома и возможность изменения значений атомной энергии.

Сотрудничество двух ученых
Кстати, Резерфорд длительное время не мог определить Ученые Марсден и Гейгер попытались осуществить перепроверку утверждений Эрнеста Резерфорда и в результате подробных и тщательных экспериментов и расчетов пришли к выводу о том, что именно ядро является важнейшей характеристикой атома, и в нем сосредоточен весь его заряд. В дальнейшем было доказано, что значение заряда ядра численно равно порядковому номеру элемента в периодической системе элементов Д. И. Менделеева. Интересно, что Нильс Бор вскоре познакомился с Резерфордом и полностью согласился с его взглядами. В последующем ученые длительно работали вместе в одной лаборатории. Модель Резерфорда, атом как система, состоящая из элементарных заряженных частиц, - все это Нильс Бор посчитал справедливым и навсегда отложил в сторону свою электронную модель. Совместная научная деятельность ученых была очень успешной и принесла свои плоды. Каждый из них углубился в изучение свойств элементарных частиц и сделал значимые для науки открытия. Позже Резерфорд обнаружил и доказал возможность разложения ядра, но это уже тема другой статьи.
Строение атома
Единицы заряда, массы и энергии в атомной физике.
Итак, заряд любой частицы содержит всегда целое число элементарных зарядов. Для частицы атомных размеров это целое число будет к тому же и небольшим. Ввиду этого в атомной физике удобно за единицу электрического заряда принять элементарный заряд е=1,60 10-19 Кл. За единицу массы в атомной физике принимается 1/12 массы атома изотопа углерода 12С. Атомная масса этого изотопа равна 12, а молярная масса М = 12 10-3 кг/моль. Поэтому атомная единица массы (а. е. м.) равна
Атомную единицу массы можно определить также как массу атома элемента с атомной массой 1. Поэтому масса атома (точнее ее средняя величина), выраженная в атомных единицах массы, равна атомной массе элемента.
Отметим, что элемента с атомной массой, равной единице, в природе не существует. Атомная масса водорода близка к единице, но несколько больше ее: она равна 1,008. Итак, масса легчайшего из атомов равна 1,008 а. е. м.
Единица энергии, принятая в атомной физике, есть энергия, приобретаемая частицей с зарядом е (например, электроном) при прохождении разности потенциалов 1 В. Эта единица носит название электронвольт и обозначается эВ. Энергия, приобретаемая зарядом при движений в электрическом поле, равна произведению заряда на разность потенциалов начальной и конечной точек пути, поэтому
1 эВ=1,6 10-19 Кл 1В=1,6 10-19Дж.
Из определения электронвольта следует, что электрон, ускоренный разностью потенциалов U [В], имеет энергию, численно равную U [эВ]. Ион с зарядом 2е, пройдя ту же разность потенциалов, приобретает энергию 2U [эВ], и т. д.
В электронвольтах можно измерять энергию не только заряженных, но и нейтральных частиц. Для примера выразим в электронвольтах энергию атома кислорода (m=16 а. е. м.), движущегося со скоростью v=103 м/c:
Используются также кратные электронвольту единицы:
1 кэВ=103 эВ, 1МэВ=106 эВ, 1 ГэВ=109 эВ, 1 ТэВ=1012 эВ.
Модель атома Резерфорда-Бора.
Все вещество состоит из элементарных частиц. Но вещество не состоит из элементарных частиц непосредственно. Кирпичиками или элементами, из которых построено все вещество являются атомы. До 1912 г. ученые представляли атом в виде положительно заряженного шара, внутри которого находятся отрицательно заряженные электроны. Конструкция похожая на кекс с изюминками-электронами была предложена однофамильцами Томсонами – Джозефом Джоном и Уильямом лордом Кельвином.

В целом положительные и отрицательные заряды в таком атоме скомпенсированы и атом электрически нейтрален. Предполагалось, что вся масса атома сконцентрирована в электронах. Поскольку электрон намного легче атома, то даже самые простые атомы должны содержать тысячи электронов.
В 1909 г. Резерфорд поручил молодому тогда еще физику Марсдену исследовать рассеяние альфа лучей при прохождении их через тонкие металлические пластинки. Большинство элементарных частиц испытывали незначительные отклонения после прохождения через пластинки. Однако Марсдену удалось обнаружить и очень сильно отклонившиеся частицы. Их, правда, было очень мало, но удивительно было то, что они вообще были. Конечно, Марсдену могло это показаться. Для регистрации альфа частиц использовался спинтарископ – небольшой прозрачный экран, покрытый специальным флуоресцирующим веществом. Когда элементарная частица попадает в такой экран, возникает слабая вспашка. Вспышка очень маленькая и слабая. Ее наблюдают под микроскопом. Чтобы глаз мог ее заметить, человек должен привыкнуть к темноте. Для этого он, прежде чем начать работать, то есть регистрировать и считать вспышки, должен полчаса посидеть в полной темноте. Вполне естественно поэтому предположить, что Марсден мог ошибиться.
Резерфорд просит Марсдена повторить опыты, но на этот раз специально следить за частицами, получившими большое отклонение вплоть до 90°.
Когда через несколько дней Марсден вошел в кабинет Резерфорда и сказал "есть такие частицы", Резерфорд от удивления выронил трубку. Резерфорд, хотя и предложил Марсдену провести эти опыты, сам не ожидал такого результата.
Резерфорд потом вспоминал: "это было самым невероятным событием моей жизни. Это было почти столь же невероятно, как если бы выстрелили 15-дюймовым снарядом в кусок тонкой бумаги, а снаряд возвратился к вам и нанес вам удар ".
Опыты снова были перепроверены, но на этот раз к экспериментам подключился Гейгер. Явление было экспериментально изучено и материалы экспериментов опубликованы в том же году. Однако смысл результатов был загадочным. Не мог атом Томсона задержать, летящую с большой скоростью альфа-частицу.
В 1911 г. Резерфорд публикует свою статью "Рассеивание альфа- и бета-частиц веществом и структура атома", в которой предлагает свою знаменитую планетарную модель атома.

Маленькое очень массивное положительно заряженное ядро, от которого как раз и отскакивали альфа-частица в описанных опытах, расположено в центре атома Резерфорда. Вокруг ядра вращаются легкие отрицательно заряженные электроны. Большую часть пространства внутри атома заполняет пустота. В целом модель очень похожа на нашу Солнечную систему.
К великому сожалению Резерфорда, статья была встречена молчанием. Резерфорд, конечно понимал почему. Его атом был недолговечен. Электрон, вращаясь вокруг ядра, должен излучать электромагнитные волны и терять вследствие этого энергию. При этом скорость его должна была бы замедлиться, и он должен был бы упасть на ядро. Однако опыт свидетельствует, что практически все атомы в природе устойчивы.
Выправил ситуацию Нильс Бор.
Теория Бора
Постулаты Бора по своему характеру аналогичны законам Кеплера, которых тоже три. И те и другие являются угаданными закономерностями, полученными на основе экспериментальных фактов. Кеплеру было пожалуй даже труднее. Как, например, можно прийти к результату, что (формула)? Только после того, как Ньютон сформулировал законы механики, законы Кеплера стало возможно объяснить.
Основным недостатком модели Резерфорда было то, что электрон, движущийся по круговой орбите вокруг ядра, должен излучать электромагнитные волны, но факты говорят о том, что он не излучает. Ученые, в том числе и Резерфорд, не могли объяснить этого противоречия. Не мог этого сделать и Бор. Он просто встал на сторону фактов: раз электроны не излучают, значит так и должно быть. Так появился первый постулат. Всего как мы уже сказали их три.
Постулаты Бора
1. Электроны движутся в атоме по стационарным орбитам, при этом они не излучают и не поглощают энергии.
2. Стационарными орбитами будут те, для которых момент количества движения электрона mvr равна целому кратному .
![]() , где k = 1, 2, 3, 4...
, где k = 1, 2, 3, 4...
3. При переходе с одной орбиты на другую электрон излучает или поглощает энергию в виде фотона.
Находясь на более далеких орбитах, электрон обладает большей энергией, поэтому, переходя на орбиту ближе к ядру, он излучает один фотон с энергией

Когда же атом поглощает фотон, электрон может подняться на более высокий уровень.
Размеры атома водорода
Электрон, вращаясь вокруг ядра, испытывает к нему силу кулоновского притяжения:

где – заряд атомного ядра с порядковым номером Z.
Эта сила в соответствии со вторым законом Ньютона должна равняться , следовательно:  или
или  .
.
Второй постулат Бора говорит нам о том, что радиус орбиты не может быть произвольным, а должен подчиняться уравнению:
где мы будем обозначать k-ую стационарную орбиту. Отсюда получаем

 .
.
Мы получили радиус k-ой стационарной орбиты атома с порядковым номером Z. Для водорода Z=1. Найдем радиус первой (k = 1) самой внутренней орбиты, на которой электрон обладает минимальным запасом энергии.
Следовательно, диаметра атома водорода равен примерно , что хорошо согласуется с экспериментальными данными.
Найдем энергию электрона на k-ой орбите.
Его энергия складывается из кинетической энергии движения по орбите и потенциальной электростатической энергии взаимодействия с ядром.
>> Строение атома. Опыты Резерфорда
Глава 12. АТОМНАЯ ФИЗИКА
Открытие сложного строения атома - важнейший этап становления современной физики, наложивший отпечаток на все ее дальнейшее развитие. В процессе создания количественной теории строения атома, позволившей объяснить атомные спектры, были открыты новые законы движения микрочастиц - законы квантовой механики.
§ 93 СТРОЕНИЕ АТОМА. ОПЫТЫ РЕЗЕРФОРДА
Модель Томсона. Не сразу ученые пришли к правильным представлениям о строении атома. Первая модель атома была предложена английским физиком Дж. Дж. Томсоном, открывшим электрон. По мысли Томсона, положительный заряд атома занимает весь объем атома и распределен в этом объеме с постоянной плотностью. Простейший атом - атом водорода - представляет собой положительно заряженный шар радиусом около 10 -8 см, внутри которого находится электрон . У более сложных атомов в положительно заряженном шаре находится несколько электронов, так что атом подобен кексу, в котором роль изюминок выполняют электроны.
Однако модель атома Томсона оказалась в полном противоречии с известными уже к тому времени свойствами атома, главным из которых является устойчивость.
Опыты Резерфорда. Масса электронов в несколько тысяч раз меньше массы атомов. Так как атом в целом нейтрален, то, следовательно, основная масса атома приходится на его положительно заряженную часть.
Для экспериментального исследования распределения положительного заряда, а значит, и массы внутри атома Эрнест Резерфорд предложил в 1906 г. применить зондирование атома с помощью -частиц. Эти частицы возникают при распаде радия и некоторых других элементов. Их масса примерно в 8000 раз больше массы электрона, а положительный заряд равен по модулю удвоенному заряду электрона. Это не что иное, как полностью ионизированные атомы гелия. Скорость -частиц очень велика: она составляет 1/15 скорости света.
Этими частицами Резерфорд бомбардировал атомы тяжелых элементов. Электроны вследствие своей малой массы не могут заметно изменить траекторию -частицы, подобно тому как камушек в несколько десятков граммов при столкновении с автомобилем не может значительно изменить его скорость.

Резерфорд Эрнест (1871 - 1937) - великий английский физик, уроженец Новой Зеландии. Своими экспериментальными открытиями заложил основы современного учения о строении атома и радиоактивности. Первым исследовал состав радиоактивных веществ. Открыл атомное ядро и впервые осуществил искусственное превращение атомных ядер. Все поставленные им опыты носили фундаментальный характер, отличались исключительной простотой и ясностью.
Рассеяние (изменение направления движения) -частиц может вызвать только положительно заряженная часть атома. Таким образом, по рассеянию -частиц можно определить характер распределения положительного заряда и массы внутри атома. Схема опытов Резерфорда показана на рисунке 12.1.
Радиоактивный препарат, например радий, помещался внутри свинцового цилиндра l, вдоль которого был высверлен узкий канал. Пучок - частиц из канала падал на тонкую фольгу 2 из исследуемого материала (золото, медь и пр.). После рассеяния -частицы попадали на полупрозрачный экран 3, покрытый сульфидом цинка. Столкновение каждой частицы с экраном сопровождалось вспышкой света (сцинтилляцией), которую можно было наблюдать в микроскоп 4. Весь прибор размещался в сосуде, из которого был откачан воздух.
При хорошем вакууме внутри прибора в отсутствие фольги на экране возникал светлый кружок, состоящий из сцинтилляций, вызванных топким пучком -частиц. Но когда на пути пучка помещали фольгу, -частицы из-за рассеяния распределялись на экране по кружку большей площади.
Модифицируя экспериментальную установку, Резерфорд попытался обнаружить отклонение -частиц на большие углы. Для этого он окружил фольгу сцинтилляциоными экранами и определил число вспышек на каждом экране. Совершенно неожиданно оказалось, что небольшое число -частиц (примерно одна из двух тысяч) отклонилось на углы, большие 90°. Позднее Резерфорд признался, что, предложив своим ученикам провести эксперимент по наблюдению за рассеянием -частиц на большие углы, он сам не верил в положительный результат. «Это почти столь же невероятно, - говорил Резерфорд, - как если бы вы выстрелили 15-дюймовым снарядом в кусок тонкой бумаги, а снаряд возвратился бы к вам и нанес вам удар».

В самом деле, предвидеть этот результат на основе модели Томсона было нельзя. При распределении по всему атому положительный заряд не может создать достаточно сильное электрическое поле, способное отбросить -частицу назад. Максимальная сила отталкивания может быть определена по закону Кулона :
где q - заряд -частицы; q - положительный заряд атома; R - его радиус; k - коэффициент пропорциональности. Напряженность электрического поля равномерно заряженного шара максимальна на поверхности шара и убывает до нуля по мере приближения к центру. Поэтому чем меньше радиус R, тем больше сила, отталкивающая -частицы.
Определение размеров атомного ядра. Резерфорд понял, что -частица могла быть отброшена назад лишь в том случае, если положительный заряд атома и его масса сконцентрированы в очень малой области пространства. Так Резерфорд пришел к мысли о существовании атомного ядра - тела малых размеров, в котором сконцентрированы почти вся масса и весь положительный заряд атома.
На рисунке 12.2 показаны траектории а-частиц, пролетающих на различных расстояниях от ядра.
Подсчитывая число -частиц, рассеянных на различные углы, Резерфорд смог оценить размеры ядра. Оказалось, что ядро имеет диаметр порядка 10 -12 -10 -13 см (у разных ядер диаметры различны). Размер же самого атома 10 -8 см, т. е. в 10-100 тысяч раз превышает размеры ядра. Впоследствии удалось определить и заряд ядра. При условии, что заряд электрона принят за единицу, заряд ядра в точности равен номеру данного химического элемента в периодической системе Д. И. Менделеева .
Планетарная модель атома. На основе своих опытов Резерфорд создал планетарную модель атома. В центре атома расположено положительно заряженное ядро, в котором сосредоточена почти вся масса атома. В целом атом нейтрален. Поэтому число внутриатомных электронов, как и заряд ядра, равно порядковому номеру элемента в периодической системе. Ясно, что покоиться электроны внутри атома не могут, так как они упали бы на ядро. Они движутся вокруг ядра, подобно тому как планеты обращаются вокруг Солнца. Такой характер движения электронов определяется действием кулоновских сил притяжения со стороны ядра.
В атоме водорода вокруг ядра обращается всего лишь один электрон. Ядро атома водорода имеет положительный заряд, равный по модулю заряду электрона, и массу, примерно в 1836,1 раза большую массы электрона. Это ядро было названо протоном и стало рассматриваться как элементарная частица. Размер атома водорода - это радиус орбиты его электрона (рис. 12.3).

Простая и наглядная планетарная модель атома имеет прямое экспериментальное обоснование. Она кажется со вершенно необходимой для объяснения опытов по рассеиванию -частиц. Но на основе этой модели нельзя объяснить факт существования атома, его устойчивость. Ведь движе ние электронов по орбитам происходит с ускорением, причем весьма немалым. Ускоренно движущийся заряд по законам электродинамики Максвелла должен излучать электромагнитные волны с частотой, равной частоте его обращения вокруг ядра. Излучение сопровождается потерей энергии. Теряя энергию, электроны должны приближаться к ядру, подобно тому как спутник приближается к Земле при торможении в верхних слоях атмосферы. Как показывают строгие расчеты, основанные на механике Ньютона и электродинамике Максвелла, электрон за ничтожно малое время (порядка 10-8 с) должен упасть на ядро. Атом должен прекратить свое существование.
В действительности ничего подобного не происходит. Атомы устойчивы и в невозбужденном состоянии могут существовать неограниченно долго, совершенно не излучая электромагнитные волны.
Не согласующийся с опытом вывод о неизбененой гибели атома вследствие потери энергии на излучение - это рс зультат применения законов классической физики к явлениям, происходящим внутри атома. Отсюда следует, что к таким явлениям законы классической физики неприменимы.
Резерфорд создал планетарную модель атома: электроны обращаются вокруг ядра, подобно тому как планеты обра1ца ются вокруг Солнца. Эта модель проста, обоснована эксне-риментально, но не позволяет объяснить устойчивсхть а тома.
1. Почему отрицательно заряженные частицы атома не оказывают заметного влияния на рассеяние -частиц!
2. Почему -частицы не могли бы рассеиваться на большие углы, если бы положительный заряд атома был распределен по всему его объему!
3. Почему планетарная модель атома не согласуется с законами классической физики !
Мякишев Г. Я., Физика. 11 класс: учеб. для общеобразоват. учреждений: базовый и профил. уровни / Г. Я. Мякишев, Б. В. Буховцев, В. М. Чаругин; под ред. В. И. Николаева, Н. А. Парфентьевой. - 17-е изд., перераб. и доп. - М. : Просвещение, 2008. - 399 с: ил.
Сборник конспектов уроков по физике скачать , календарно-тематическое планирование, учебники по всем предметам онлайн
Содержание урока конспект урока опорный каркас презентация урока акселеративные методы интерактивные технологии Практика задачи и упражнения самопроверка практикумы, тренинги, кейсы, квесты домашние задания дискуссионные вопросы риторические вопросы от учеников Иллюстрации аудио-, видеоклипы и мультимедиа фотографии, картинки графики, таблицы, схемы юмор, анекдоты, приколы, комиксы притчи, поговорки, кроссворды, цитаты Дополнения рефераты статьи фишки для любознательных шпаргалки учебники основные и дополнительные словарь терминов прочие Совершенствование учебников и уроков исправление ошибок в учебнике обновление фрагмента в учебнике элементы новаторства на уроке замена устаревших знаний новыми Только для учителей идеальные уроки календарный план на год методические рекомендации программы обсуждения Интегрированные урокиТема этого занятия - «Модели атомов. Опыт Резерфорда». На нём мы узнаем, как происходило изучение учеными сложной структуры атомов, как нашли объяснение этой теории, где полученные знания применяются на сегодняшний день. Также мы рассмотрим, как с помощью опыта Резерфорда можно изучить модель атома.
На предыдущем уроке мы обсудили, что в результате радиоактивности образуются различные виды излучений: a-, b-, и g-лучи. Появился инструмент, при помощи которого можно было изучать строение атома.
После того, как стало ясно, что атом тоже имеет сложную структуру, как-то по-особенному устроен, необходимо было исследовать само строение атома, объяснить, как он устроен, из чего состоит. И вот ученые приступили к этому изучению.
Первые идеи о сложном строении были высказаны Томсоном , который в 1897 году открыл электрон. В 1903 году Томсон впервые предложил модель атома. По теории Томсона, атом представлял собой шар, по всему объему которого «размазан» положительный заряд. А внутри, как плавающие элементы, находились электроны. В целом, по Томсону, атом был электронейтрален, т. е. заряд такого атома был равен 0. Отрицательные заряды электронов компенсировали положительный заряд самого атома. Размер атома составлял приблизительно 10 -10 м. Модель Томсона получила название «пудинг с изюмом»: сам «пудинг» - это положительно заряженное «тело» атома, а «изюм» - это электроны (рис. 1).
Рис. 1. Модель атома Томсона («пудинг с изюмом»)
Первый достоверный опыт по определению строения атома удалось провести Э. Резерфорду . На сегодняшний день мы твердо знаем, что атом представляет собой структуру, напоминающую планетную солнечную систему. В центре находится массивное тело, вокруг которого вращаются планеты. Такая модель атома получила название планетарной модели.
Давайте обратимся к схеме опыта Резерфорда (рис. 2) и обсудим результаты, которые привели к созданию планетарной модели.

Рис. 2. Схема опыта Резерфорда
Внутрь свинцового цилиндра с узким отверстием был заложен радий. При помощи диафрагмы создавался узкий пучок a-частиц, которые, пролетая через отверстие диафрагмы, попадали на экран, покрытый специальным составом, при попадании возникала микро-вспышка. Такое свечение при попадании частиц на экран называется «сцинтиляционная вспышка». Такие вспышки наблюдались на поверхности экрана при помощи микроскопа. В дальнейшем до тех пор, пока в схеме не было золотой пластины, все частицы, которые вылетали из цилиндра, попадали в одну точку. Когда же внутрь экрана на пути летящих a-частиц была поставлена очень тонкая пластинка из золота, стали наблюдаться совершенно непонятные вещи. Как только была поставлена золотая пластина, начались отклонения a-частиц. Были замечены частицы, которые отклонялись от своего первоначального прямолинейного движения и уже попадали в совершенно другие точки этого экрана.
Более того, когда экран сделали почти замкнутым, выяснилось, что есть частицы, которые каким-то образом летят в обратную сторону. Они отклоняются под углом 90° и больше. Эти наблюдения были проанализированы Резерфордом, и выяснилась следующая довольно любопытная вещь.
В первую очередь здесь потерпела крах теория Томсона. По теории Томсона, атом представляет собой шар размером 10 -10 м, в котором положительный заряд размазан и есть электрон. Так вот, электроны - это очень маленькие частицы, они не могут препятствовать a-частицам, летящим с приличной скоростью. Скорость a-частиц в данном случае составляла около 10000 км/с.
Представьте себе ситуацию, когда грузовик столкнется с игрушечным автомобилем. Понятно, что грузовик даже не заметит такого автомобиля. Это мы можем привести как аналогию столкновения электрона с a-частицей. Значит, необходимо было сделать вывод, что атом устроен иначе, не так, как утверждал Томсон. И, видимо, в атоме золота есть объект более массивный, чем a-частица, имеющий положительный заряд.
Давайте посмотрим еще одну картину, которая характеризует рассеивание a-частиц на той массивной частице, наличие которой предсказал Резерфорд в атоме (рис. 3).

Рис. 3. Рассеивание альфа-частиц По результатам опытов можно было говорить, что в атоме есть массивный положительно заряженный объект. a-частица, сталкиваясь с этой большой частицей, может отразиться обратно. Те частицы, которые пролетают рядом, отклоняются на разные углы. Чем дальше a-частица пролетает от этого объекта, тем на меньший угол они отклоняются. Такое явление получило название «рассеивание a-частиц ».
Крупную частицу, которая находится внутри атома, Резерфорд назвал ядром. И даже оценил его размеры. По оценке Резерфорда, размеры ядра составили 10 -14 -10 -15 м. Этот объект был очень и очень мал по своим размерам по сравнению с атомом. Атом имеет размер порядка 10 -10 м. При этом практически вся масса атома была сосредоточена именно в ядре. И именно вокруг ядра обращаются электроны.
Отсюда следует планетарная модель Резерфорда, которая утверждает, что атом представляет собой массивное положительно заряженное ядро, вокруг которого по своим орбитам обращаются электроны (рис. 4). В целом атом электронейтрален, т. е. заряд атома равен нулю. Если у атома избыток или недостаток электронов, то его называют ион.

Рис. 4. Планетарная модель атома
Конечно, были и другие теории, представляющие интерес. На сегодняшний день общепринятой, с некоторыми оговорками, о которых поговорим позднее, является именно планетарная модель атома, предложенная Эрнестом Резерфордом.
Список литературы
- Бронштейн М.П. Атомы и электроны. «Библиотечка “Квант”». Вып. 1. - М.: Наука, 1980.
- Кикоин И.К., Кикоин А.К. Физика: Учебник для 9 класса средней школы. - М.: «Просвещение».
- Китайгородский А.И. Физика для всех. Фотоны и ядра. Книга 4. - М.: Наука.
- Мякишев Г.Я., Синякова А.З. Физика. Оптика Квантовая физика. 11 класс: учебник для углубленного изучения физики. - М.: Дрофа.
- Ньютон И. Математические начала натуральной философии. - М.: Наука, 1989.
- Резерфорд Э. Избранные научные труды. Радиоактивность. - М.: Наука.
- Резерфорд Э. Избранные научные труды. Строение атома и искусственное превращение элементов. - М.: Наука.
- Эйнштейн А., Инфельд Л. Эволюция физики. Развитие идей от первоначальных понятий до теории относительности и квантов. - М.: Наука, 1965.